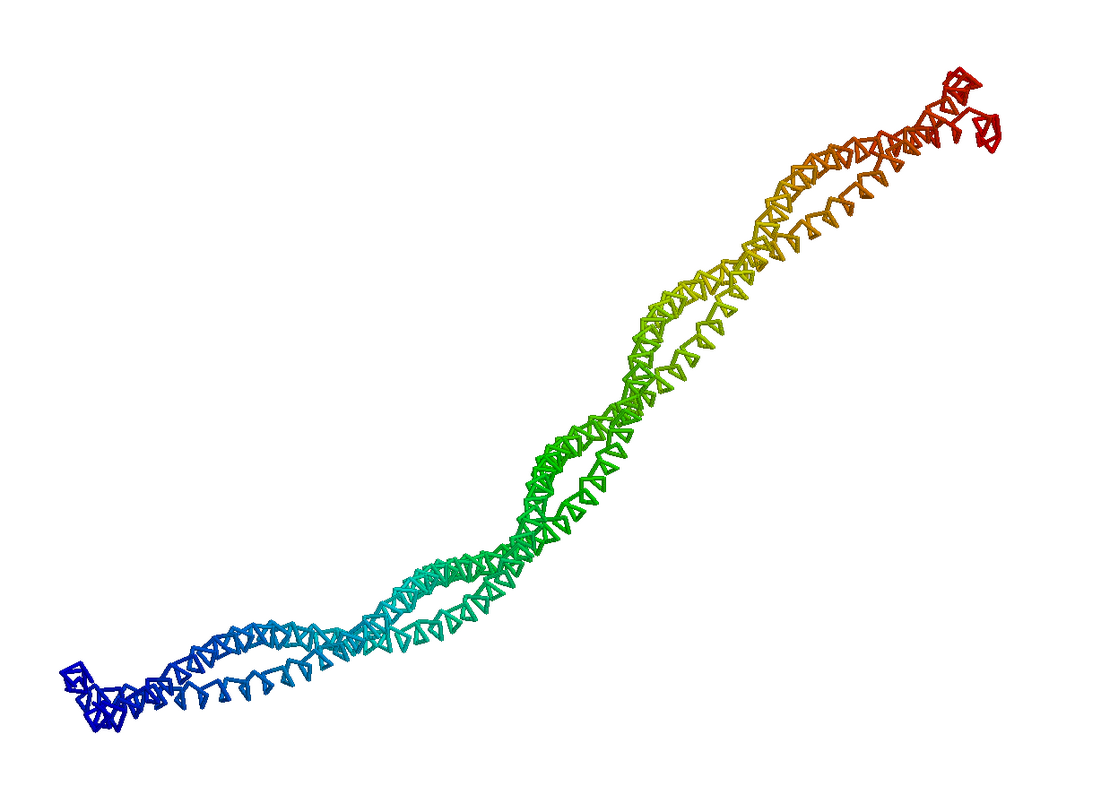热门问题
时间线
聊天
视角
捲曲螺旋
来自维基百科,自由的百科全书
Remove ads
捲曲螺旋(英語:coiled coil)是一種蛋白質超二級結構,由2-7[1]個α螺旋(最常見的是2或4個)互相纏繞形成麻花狀結構。許多具有重要生物學功能(如基因表達調控中的轉錄因子)蛋白質含有捲曲螺旋。


許多含有捲曲螺旋結構的蛋白質具有重要的生物學功能,例如基因表達的調控中的轉錄因子。含有捲曲螺旋結構最知名的蛋白質有原癌蛋白(oncoprotein)c-fos和jun,以及原肌球蛋白(tropomyosin,一種肌肉蛋白)。
歷史
在萊納斯·鮑林和他的同事於1951年提出α螺旋結構[2]後不久,弗朗西斯·克里克就於1952年提出了α-角蛋白中可能存在由α螺旋互相纏繞而形成捲曲螺旋。[3]
結構
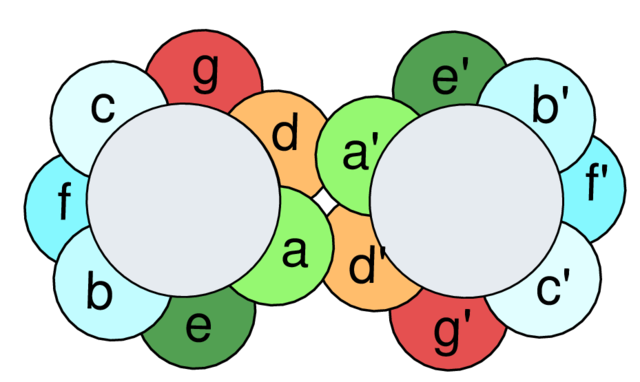
形成捲曲螺旋的蛋白質序列中通常具有序列重複現象,每個重複序列區含有七個氨基酸,被稱為七肽重複區(heptad repeat)。捲曲螺旋中螺旋之間相互作用的表面常含有疏水氨基酸,如亮氨酸,而由亮氨酸在相互作用表面的排列就形成了「亮氨酸拉鏈」(亮氨酸如同拉鏈一般相互作用)。在細胞質這樣一個水環境中,兩個螺旋排列在一起最好的方式就是將它們的疏水氨基酸相對,而親水氨基酸則朝外;這樣就使得疏水表面不會暴露於水環境中。這種對疏水表面的包埋為兩個螺旋的二聚化提供了熱力學驅動力。
形成捲曲螺旋的α螺旋之間的關係可以是平行的或反平行的,並且這些α螺旋通常採用「左手」型超螺旋。少量「右手」型捲曲螺旋也存在於自然界中,或者通過蛋白質工程設計而達成。[4]
生物學功能

愛滋病毒(HIV)侵入人體細胞中關鍵的一個步驟是由反平行捲曲螺旋構成的gp41三聚體的暴露。gp41三聚體一般是被另一個病毒表面糖蛋白gp120所覆蓋,以保護gp41免受抗體識別。當病毒結合到靶細胞上時,gp120發生結構變化,將gp41三聚體暴露出來使得gp41的疏水N端尾部插入靶細胞的細胞膜。gp41上的三個α螺旋摺疊到gp41的捲曲螺旋三聚體上形成六聚體,並將病毒外膜與靶細胞的細胞膜拉到足夠近而發生膜融合。然後,病毒就可以進入細胞,開始自身複製。
由於捲曲螺旋的特異性作用並且常常形成二聚體,因此捲曲螺旋被用作二聚化的標籤應用於需要二聚化的蛋白質。
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads