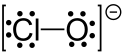热门问题
时间线
聊天
视角
次氯酸鹽
来自维基百科,自由的百科全书
Remove ads
次氯酸鹽是次氯酸的鹽,含有次氯酸根離子ClO−,其中氯的氧化態為+1。次氯酸鹽常以溶液態存在,不穩定,會發生歧化反應生成氯酸鹽和氯化物。見光分解為氯化物和氧氣。常見的次氯酸鹽包括次氯酸鈉(漂白劑)和次氯酸鈣(漂白粉),都是很強的氧化劑,可與很多有機化合物強烈放熱反應,可能發生燃燒。可氧化錳化合物為高錳酸鹽。次氯酸根中的 Cl-O 鍵長是 210 pm。[1]
Remove ads
反應
次氯酸鹽和酸反應形成次氯酸,並和氯氣形成平衡。在高pH下平衡會趨向左邊:
- 2 H+
+ ClO−
+ Cl−
⇌ Cl
2 + H
2O
次氯酸鹽普遍不穩定,只能存在於溶液。次氯酸鋰(LiClO)、次氯酸鈣(Ca(ClO)2)和次氯酸鋇(Ba(ClO)2)已經得到了純的無水物。它們都是固體。剩下的都只能以水合物或水溶液的形式存在。一般來說,水溶液越稀就越穩定。對於鹼土金屬次氯酸鹽的性質推測是不可能的,因為大部分次氯酸鹽都仍未合成。次氯酸鈹不存在。純的次氯酸鎂不存在,不過Mg(OH)ClO是已知的。[3] 次氯酸鈣的生產已是工業級的了,穩定性也較好。次氯酸鍶(Sr(ClO)2)的性質及穩定性都不明確。[來源請求]
- 2 ClO−
→ 2 Cl−
+ O
2 - 3 ClO−
→ 2 Cl−
+ ClO−
3
這個反應是放熱的,因此純的LiClO和Ca(ClO)2會導致熱失控,可能會爆炸。[4]
鹼金屬次氯酸鹽隨着族往下,越來越不穩定。無水次氯酸鋰在室溫下穩定。不過,次氯酸鈉已經不能合成到比五水物 (NaClO·(H2O)5)更干的次氯酸鈉了。它在 0 °C以上是不穩定的,[5] 儘管作為家用漂白劑的稀次氯酸鈉溶液具有更好的穩定性。次氯酸鉀 (KClO) 只在溶液中存在。[3]
鑭系元素次氯酸鹽不穩定。不過,有報告稱它們的無水物比水合物更穩定。[6] 次氯酸鹽可以把鈰的氧化態從 +3 氧化到+4。[7]
次氯酸鹽和氨反應,形成氯胺 (NH
2Cl),之後是二氯胺 (NHCl
2),最後是三氯化氮 (NCl
3)。[8]
- NH
3 + ClO−
→ HO−
+ NH
2Cl
- NH
2Cl + ClO−
→ HO−
+ NHCl
2
- NHCl
2 + ClO−
→ HO−
+ NCl
3
檢驗
溶解性
參見
- 次氯酸酯
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads