热门问题
时间线
聊天
视角
Fischer卡賓
来自维基百科,自由的百科全书
Remove ads
Fischer卡賓是二價的有機金屬配合物卡賓。Fischer卡賓的中心碳原子將其 sp2雜化軌道上的電子提供給中心金屬的d軌道中,而中心金屬以反饋鍵的方式將一對電子提供給碳原子上空的π軌道中。Fischer卡賓的中心金屬的π反饋鍵通常較弱,金屬價態較低,因此總體上Fischer卡賓是親電性的。
Fischer卡賓的命名來源於恩斯特·奧托·菲舍爾。
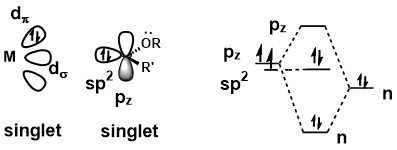
結構
Fischer卡賓是一種單線態卡賓,卡賓上取代基的孤對電子離域提高了碳pz軌道的能量,從而使得卡賓的兩個電子保持成對。卡賓和中心金屬的成鍵包括一個強的sp2提供給金屬d軌道的σ鍵,和從中心金屬處接受至pz軌道的弱π鍵。[1]
由於這種成鍵方式,Fischer卡賓通常有以下特徵:
1、低價態的中心金屬
3、能夠接受π電子的配體
製備
Fischer卡賓的最常見合成方法是金屬羰基化合物與烴基鋰反應,生成酰基金屬羰基配合物。此過程中得到的近似烯醇鋰的結構高度穩定,因此需要用高親電性的烷基化試劑(如Meerwein鹽)。[2]以碘甲烷作烷基化試劑可以通過相轉移體系完成。[3]此種方式合成的Fischer卡賓為電中性卡賓。鋰可以以四烷基銨離子代替,以得到活性更強的烯醇。得到的中性四烷基銨鹽可以酰化得到具有高親電性的酰基配合物,可通過與醇發生親核取代得到Fischer卡賓[4],此種方式合成的Fischer卡賓為陽離子卡賓。
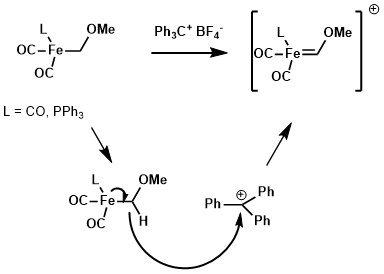
使用合適的提氫試劑,如三苯甲基陽離子試劑,金屬配合物烷基配體上的氫能被奪走並得到Fischer卡賓。[2]
相關反應
Fischer卡賓是親電性的,經常表現出和羰基化合物相似的反應性。許多反應可以以羧基等價結構來理解,如酯交換反應、Michael加成和羥醛縮合。如圖Cr(CO)5部分是一個強吸電子基團,使卡賓α-H有酸性。有甲基側鏈的甲氧基鉻卡賓在乙腈水溶液中的pKa為12.5(體積比1:1)。[6][7] 作為參考,乙酸甲酯的pKa為25.6,證明Cr(CO)5有較強的吸電子能力。
Fischer卡賓的親電性也能體現在許多反應中。例如,丙烯酸甲酯和異戊二烯的Diels-Alder反應在室溫下需要7天完成,且對/間位的選擇性低。但是,對應的Fischer卡賓反應在室溫下3小時即可完成,並且有更高的對位選擇性。[8]
烏洛托品是一種弱的親核試劑,能夠參與到炔基Fischer卡賓的Michael加成反應中,得到一種有趣的雙重加合產物。[9]
通過Fischer卡賓的去質子化獲得的類烯醇結構可以烷基化。然而,因為碳負離子高度穩定,所以需要活性的烷基化試劑,例如氟磺酸甲酯或溴乙酸甲酯。[10][11]
Fischer卡賓能夠使用溫和的氧化劑,如硝酸鈰銨,脫去金屬得到對應的羰基化合物。[2]
如果Fischer卡賓的側鏈上有α-H,他可以與弱鹼發生反應,如吡啶。這可以得到氫化鉻類物質,經還原消除後得到順式烯醇醚。[14]
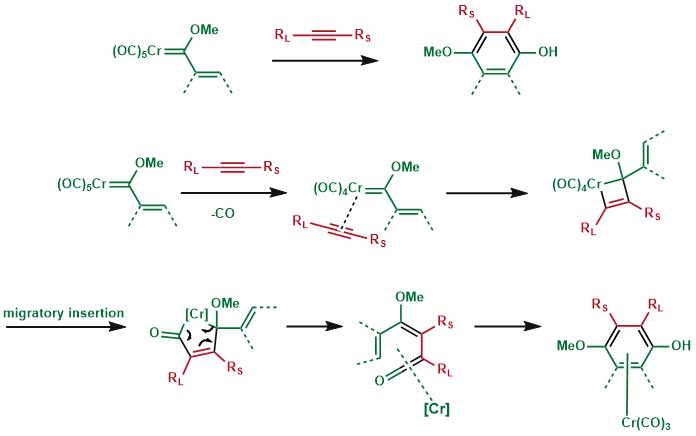
含烯基側鏈的Fischer卡賓與炔烴反應,能得到苯酚結構,酚基碳來源於CO配體,其上α,β-不飽和部分可能來自富電子芳環體系,最終得到多環芳香結構。該反應首先由Karl Heinz Dötz發現,並由他的小組和William D. Wulff推廣發展,因此得名。[15]
Dötz反應中的半夾心配合物可以脫去金屬得到對應的芳基產物,他可以通過進一步的親核加成合成高度取代的芳環產物。[16]
某些環境中,如果試劑的反應性不足或Dötz反應機理發生的條件不滿足時,Dötz反應產物會被中斷,得到以烯酮中間體為主的產物。例如,如果炔烴上的取代基太大,可能會得到環丁烯結構。[19]
如果炔酮結構兩側的取代基R和R』空間體積不大時,產物可能以8電子π環化的構象為主,如所示得到稠合雙環內酯結構。[20] [21] [22]
炔烴反應物側鏈上的烯烴或親核部分可以分別通過[2+2]環加成或親核加成來捕獲生成的烯酮。該反應被用於合成廣譜的抗黴素,如Blastmycinone(一種三取代內酯)及Antimycinone。[23][24][25]
有α-H的Fischer卡賓可以通過類似於葆森–侃德反應得到環戊烯酮結構。[26]
如果Fischer卡賓中含有不共軛的烯烴結構,則可以得到環丙烷化的橋烴,該反應被用於天名精內酯酮的合成中。[27][28]
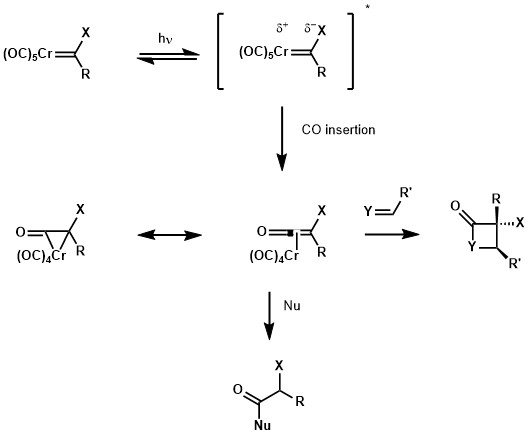
Fischer卡賓的UV-Vis光譜在近紫外區顯示出金屬到配體的電荷轉移帶。一方面,電子從金屬軌道激發至配體軌道能夠讓卡賓碳更富電子化。另一方面,由於金屬的羰基配體而已經缺電子的中心金屬變得更加缺電子,促進了CO配體的遷移插入。這種遷移插入得到了鉻環丙酮,鉻化的乙烯酮共振形式。由於有着烯酮的反應性,該物質可以被親核試劑(如醇或胺)所捕獲,或者與烯烴、亞胺或醛發生[2+2]環加成反應,得到對應的環丁烷、β-內酰胺和β-內酯加合物。[29]
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads