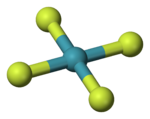
四氟化氙(化學式:XeF4)是貴氣體氙的氟化物之一,是第一個發現的貴氣體二元化合物。[2]
| 四氟化氙 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Xenon tetrafluoride | |||
| 別名 | 氟化氙(IV) | ||
| 識別 | |||
| CAS編號 | 13709-61-0 | ||
| PubChem | 123324 | ||
| ChemSpider | 109927 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | RPSSQXXJRBEGEE-UHFFFAOYAW | ||
| 性質 | |||
| 化學式 | XeF4 | ||
| 摩爾質量 | 207.2836 g·mol⁻¹ | ||
| 外觀 | 白色固體 | ||
| 密度 | 4.040 g/cm3 (固) | ||
| 升華條件 | 117 °C (390 K)[1] | ||
| 結構 | |||
| 配位幾何 | D4h | ||
| 分子構型 | 平面正方形 | ||
| 偶極矩 | 0 D | ||
| 危險性 | |||
| 閃點 | ? °C | ||
| 相關物質 | |||
| 相關化學品 | 二氟化氙、六氟化氙 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
製造
- 首次製備的方法:由Xe與F2以1:2摩爾比反應得到。[3][4]該反應是放熱反應,每摩爾反應放出251kJ的熱量。[2]
- 放電合成法:將氙與氟按體積比1:2加入反應容器(溫度需控制在-78℃),放電條件為1100V、31mA到2800V、12mA,反應歷時3小時。電壓不能太高否則氙與氟發生燃燒反應。為了主要獲得四氟化氙,氟需要略微過量。
- 二氟化二氮氟化法:在200℃以下將二氟化二氮與氙共熱,主要得到四氟化氙。該法可以避免使用危險且難以製備的氟單質。
物理性質
四氟化氙是一種無色固體,室溫下易升華。四氟化氙微溶於無水氟化氫,但並不電離。它不溶於全氟庚烷中,但可溶於NOF·3HF。[5]
結構
1963年核磁共振譜與X射線晶體學數據顯示其四氟化氙的空間構型為平面正方形。[6][7]四氟化氙為體心單斜晶系,X射線繞射法和中子繞射法測得Xe-F鍵鍵長約為190pm。
化學性質
四氟化氙在室溫下穩定,可以長期儲存在鎳制容器中,如果去除水和氟化氫也可保存在玻璃容器中。
- 它能被氫氣還原,該反應可用於分析鑑定:
- 這個反應機理很複雜,Xe(IV)先發生歧化反應得到Xe(0)和Xe(VI),然後分別氧化水並放出氧氣。
- 它在撞擊或震動下都很穩定,不會爆炸性分解。但與有機物(例如四氫呋喃、二氧六環、丙酮、乙烯)接觸時會劇烈反應而引起燃燒。如果與氣態的乙醇或丙酮反應將發生爆炸。
- 氟磺酸中的-OSO2F是電負性很高的基團,可取代四氟化氙中的氟原子形成衍生物:
- 但後來化學家再次進行該實驗時,只得到了二氟化氙的衍生物。這可能是過去使用的四氟化氙不純造成的。[5]
- 以下是四氟化氙參與的有機反應:
參考資料
參見
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.