热门问题
时间线
聊天
视角
施特雷克尔氨基酸合成反应
氨基酸的合成方法 来自维基百科,自由的百科全书
Remove ads
施特雷克尔氨基酸合成反应(英语:Strecker amino acid synthesis),也简称施特雷克尔合成(Strecker synthesis),是一种在氨存在下,通过醛与氰化物反应合成氨基酸的方法。该缩合反应生成α-氨基腈,随后水解得到目标氨基酸。[1][2] 该方法用于从甲硫基丙醛商业化生产外消旋甲硫氨酸。[3]
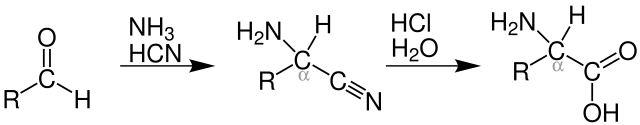
Remove ads
反应机理
在反应过程的第一阶段,羰基转化为亚胺离子,氰离子随后加成到亚胺离子上。首先,醛的羰基氧被质子化,然后氨对羰基碳进行亲核攻击。经过后续的质子交换后,脱水生成亚胺离子中间体。氰离子随后进攻亚胺碳,生成氨基腈。

在反应过程的第二部分,腈发生水解。首先,氨基腈的腈氮原子被质子化,腈碳原子受到水分子的亲核攻击。质子交换后,水分子对原腈碳原子进行亲核攻击,生成1,2-二氨基二醇。随后,氨基质子化后消除氨,最后羟基去质子化生成氨基酸。

不对称施特雷克尔反应
施特雷克尔合成的一个例子是以甲基异丙基酮为起始原料,以多公斤级规模合成L-缬氨酸衍生物:[5]
- (CH
3)
2CHC(O)CH
3 + HCN + NH
3 → (CH
3)
2CHC(CN)(NH
2)CH
3 + H
2O
3-甲基-2-丁酮与氰化钠和氨的初始反应产物可通过加入L-酒石酸进行拆分。相比之下,不对称施特雷克尔反应则无需拆分剂。用(S)-α-苯乙胺代替氨作为手性辅助剂,最终反应产物为手性丙氨酸。[6]

可以使用硫脲衍生的催化剂进行催化不对称施特雷克尔反应。[7]2012年,采用BINOL衍生的催化剂生成手性氰化物阴离子(见图)。[8]
历史
德国化学家阿道夫·施特雷克尔发现了由醛或酮生成氨基酸的一系列化学反应。[9][10] 在此反应中使用氨或铵盐可得到未取代的氨基酸。最初的施特雷克尔反应中,乙醛、氨和氰化氢结合,水解后生成丙氨酸。研究表明,用伯胺和仲胺代替铵盐可得到N-取代的氨基酸。[10]
经典的施特雷克尔合成得到的是α-氨基酸的外消旋混合物,但人们已经开发出几种使用不对称助剂[11] 或不对称催化剂[12][13] 的替代方法。
不对称施特雷克尔反应(asymmetric Strecker reaction)最早由原田于1963年报道。[14] 1996年首次报道了使用手性催化剂进行不对称合成。[15] 然而,该决定于2023年被撤回。[16]
氨基酸的商业合成
除了施特雷克尔合成法之外,还有几种合成氨基酸的方法。[17][3]
然而,氨基酸的商业化生产通常依赖于以葡萄糖为碳源、能够过量生产特定氨基酸的突变细菌。此外,氨基酸还可以通过合成中间体的酶促转化来生产。2-氨基噻唑啉-4-羧酸是L-半胱氨酸工业合成中的一种中间体。天冬氨酸则是在裂合酶的作用下,通过氨与富马酸加成反应制得。[3]
参考文献
参阅
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads