乙烯(英语:Ethylene)是由两个碳原子和四个氢原子组成的化合物。两个碳原子之间用双键连接。
| 乙烯 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 Ethene | |||
| 识别 | |||
| CAS号 | 74-85-1 | ||
| PubChem | 6325 | ||
| ChemSpider | 6085 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | VGGSQFUCUMXWEO-UHFFFAOYAE | ||
| EC编号 | 200-815-3 | ||
| 性质 | |||
| 化学式 | C2H4 | ||
| 摩尔质量 | 28.05 g·mol⁻¹ | ||
| 外观 | 无色、无臭、稍带有甜味的气体 | ||
| 密度 | 1.178 g/l(15 °C,气体)[1] | ||
| 熔点 | −169.2 °C [1] | ||
| 沸点 | −103.7 °C [1] | ||
| 临界点 | 282.4 K (9.2 °C) 在 5.04 MPa (50个大气压) | ||
| pKa | 44 | ||
| 结构 | |||
| 分子构型 | D2h | ||
| 偶极矩 | 零 | ||
| 热力学 | |||
| ΔfHm⦵298K | +52.47 kJ/mol | ||
| S⦵298K | 219.32 J·K−1·mol−1 | ||
| 危险性 | |||
| 欧盟分类 | Extremely flammable (F+) | ||
| NFPA 704 | |||
| 闪点 | -136 °C (−213 °F; 137 K) | ||
| 自燃温度 | 542.8 °C | ||
| 相关物质 | |||
| 相关化学品 | 乙烷、乙炔 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
乙烯为合成纤维、合成橡胶、合成塑料(聚乙烯及聚氯乙烯)、合成乙醇(酒精)的基本化工原料,也用于制造氯乙烯、苯乙烯、环氧乙烷、醋酸、乙醛、乙醇和炸药等,且可用作水果和蔬菜的催熟剂,是一种已证实的植物激素,也是石油化工发展水准之指标。
分子结构
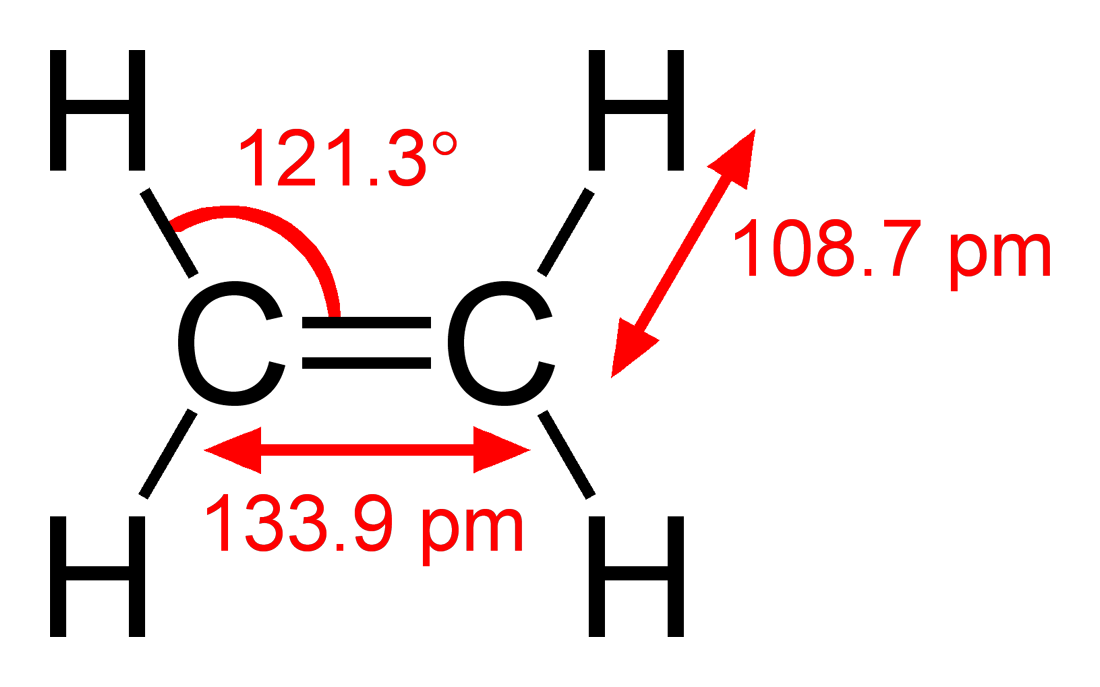
乙烯有4个氢原子,碳原子之间以双键连接,6个原子共面。H-C-C键角为121.3°;H-C-H键角为117.4°,接近120°,是理想的sp2杂化轨道。这种分子也比较僵硬:旋转C=C键是一个高吸热过程,需要打破π键而保留σ键。
双键是一个高电子密度的区域,因而大部分反应发生在这个位置。
生产方法
乙烯是由石油化工裂解而成。在这个过程中,气态或轻液态烃被加热到750-950℃,诱使许多自由基反应,然后立即淬火冻结。这个过程中,大分子碳氢化合物转化为较小分子的碳氢化合物,并生成不饱和烃。
化学反应
乙烯在石油化工等行业是一个极为重要的试剂,它的产量标志着一个国家的石油化工的能力。它可以进行多种类型的反应,从而制出各种化工产品。
其反应包括:
实验室制法
工业上所用的乙烯,主要是从石油化工所生产的气体产品中分离出来的。在实验室中,则通常是通过加热酒精和浓硫酸的混合物,使酒精分解而制得乙烯。在这个反应中,浓硫酸起催化剂和脱水剂的作用,其反应方程式如下:
CH3CH2OH 浓H2SO4 CH2=CH2↑ + H2O △
注意,此反应应当迅速加热混合物(一般加热到170摄氏度左右),否则将会产生副产物乙醚(乙醚生成温度一般于140摄氏度左右)。
毒性现象
乙烯在低浓度时,有刺激作用,高浓度时具有较强的麻醉作用,但无明显兴奋阶段,麻醉快,苏醒也快。对皮肤粘膜没有刺激作用。主要中毒途径是呼吸道吸入,其次为皮肤接触。
突然吸入80~90%高浓度乙烯,可立刻引起意志丧失;吸入75-90%乙烯与氧的混合气可引起麻醉;吸入61%乙烯4分钟,产生反应迟钝;吸入25-45%乙烯有痛觉消失和记忆力减退。
植物激素
乙烯在植物生理上扮演植物激素的角色[2][3][4]。作为植物的催熟剂,以气体方式微量作用在植物,刺激或调节果实成熟、开花和植物叶片掉落。因以气体形式扩散,甚至会影响其他种类的植物。
在植物体内乙烯合成主要是由甲硫胺酸做起始物,1-胺基环丙烷-1-羧酸(ACC)为关键中间产物。可以天然或人工合成。
参见
参考文献
延伸阅读
外表链接
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.