
二氟化氧
化合物 / 维基百科,自由的 encyclopedia
二氟化氧是化学式为OF2的化合物,结构与水分子相似,但化学性质非常不同,是强氧化剂。
Quick Facts 二氟化氧, 识别 ...
| 二氟化氧 | |
|---|---|
 | |
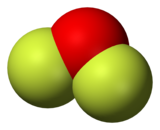 | |
| 别名 | 氟化氧 次氟酸酐 |
| 识别 | |
| CAS号 | 7783-41-7 |
| PubChem | 24547 |
| ChemSpider | 22953 |
| SMILES |
|
| InChI |
|
| InChIKey | UJMWVICAENGCRF-UHFFFAOYAI |
| EINECS | 231-996-7 |
| ChEBI | 30494 |
| RTECS | RS2100000 |
| 性质 | |
| 化学式 | OF2 |
| 摩尔质量 | 53.9962 g·mol⁻¹ |
| 外观 | 无色气体,冷凝后得到淡黄色液体 |
| 密度 | -145°C液态下为1.9 g/cm3 |
| 熔点 | −223.8 °C |
| 沸点 | −144.8 °C |
| 溶解性(其他溶剂) | 一升水能溶解68毫升二氟化氧(0℃) |
| 热力学 | |
| ΔfHm⦵298K | 24.5 kJ mol−1 |
| 相关物质 | |
| 相关化学品 | HFO O2F2 NHF2 NF3 SCl2 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
Close