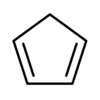
环戊二烯
一种化合物 / 维基百科,自由的 encyclopedia
环戊二烯(英语:cyclopentadiene),有时会称为茂[注 1]化氢(CpH)[来源请求][注 2],是五个碳的环状二烯烃,分子式为C5H6。环戊二烯室温下为无色液体,具有强烈的刺激性气味。在室温时会发生狄尔斯-阿尔德反应,迅速聚合生成二聚环戊二烯,二聚体加热又可分解为环戊二烯。环戊二烯不溶于水,易溶于乙醚、苯等溶剂。 环戊二烯基可以简写为Cp。
Quick Facts 环戊二烯, 识别 ...
| 环戊二烯 | |||
|---|---|---|---|
| |||

| |||
| 系统名 Cyclopenta-1,3-diene[1] 1,3-环戊二烯 | |||
| 别名 | 茂 | ||
| 识别 | |||
| 缩写 | CPD, HCp | ||
| CAS号 | 542-92-7 | ||
| PubChem | 7612 | ||
| ChemSpider | 7330 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | ZSWFCLXCOIISFI-UHFFFAOYAI | ||
| Beilstein | 471171 | ||
| Gmelin | 1311 | ||
| EINECS | 208-835-4 | ||
| ChEBI | 30664 | ||
| RTECS | GY1000000 | ||
| MeSH | 1,3-cyclopentadiene | ||
| 性质 | |||
| 化学式 | C5H6 | ||
| 摩尔质量 | 66.1 g·mol−1 | ||
| 外观 | 无色液体 | ||
| 密度 | 786 mg cm-3 | ||
| 熔点 | -90 °C(183 K) | ||
| 沸点 | 39-43 °C(312-316 K) | ||
| pKa | 16 | ||
| pKb | -2 | ||
| 结构 | |||
| 分子构型 | 平面型[2] | ||
| 热力学 | |||
| S⦵298K | 182.7 J K-1 mol-1 | ||
| 热容 | 115.3 J K-1 mol-1 | ||
| 危险性 | |||
| 欧盟危险性符号 | |||
| 警示术语 | R:R11-R20/22-R36/37/38-R51/53 | ||
| 安全术语 | S:S2-S36/37-S61 | ||
| GHS危险性符号 | |||
| GHS提示词 | 危险 | ||
| H-术语 | 225-301-311-332-371 | ||
| 闪点 | 25 °C | ||
| MAK | 不固定[3] | ||
| 相关物质 | |||
| 相关碳氢化合物 | 苯、环丁二烯 | ||
| 相关化学品 | 二聚环戊二烯 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
Close