破骨细胞
维基百科,自由的 encyclopedia
破骨细胞(英语:osteoclast)又称蚀骨细胞[1],是一种存在于骨组织中的细胞,由多个单核细胞融合而成,直径最大可达100微米,细胞核的数目一般是6-50个[2][3]。破骨细胞由核因子B配体激活受体(RANKL),以及巨噬细胞集落刺激因子(M-CSF)刺激分化产生。它的主要功能是通过释放乳酸、柠檬酸、碳酸、碳酸酐酶及溶酶体酶等,对骨组织进行分解破坏[2],是体内唯一具有骨吸收活性的细胞[4][5][6]。
| 此条目目前正依照英语维基百科上的内容进行翻译。 (2019年11月9日) |
Quick Facts 破骨细胞 Osteoclast, 基本信息 ...
| 破骨细胞 Osteoclast | |
|---|---|
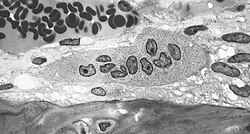 图中央为破骨细胞,可见破骨细胞有多个核。图下方的组织即骨组织,图左上方的结构为血 管 | |
| 基本信息 | |
| 位置 | 骨组织 |
| 功能 | 溶解破坏骨组织 |
| 标识字符 | |
| 拉丁文 | osteoclastus |
| MeSH | D010010 |
| TH | H2.00.03.7.00005 |
| FMA | FMA:66781 |
| 《显微解剖学术语(英语:Anatomical terms of microanatomy)》 [在维基数据上编辑] | |
Close
破骨细胞于1873年由德国的阿尔伯特·冯·科立克最早发现[7]。英语 osteoclast 中,osteo- 来自古希腊语 ὀστέον(osteon),意为骨;-clast 来自古希腊语 κλαστός(clastos),意为破坏。