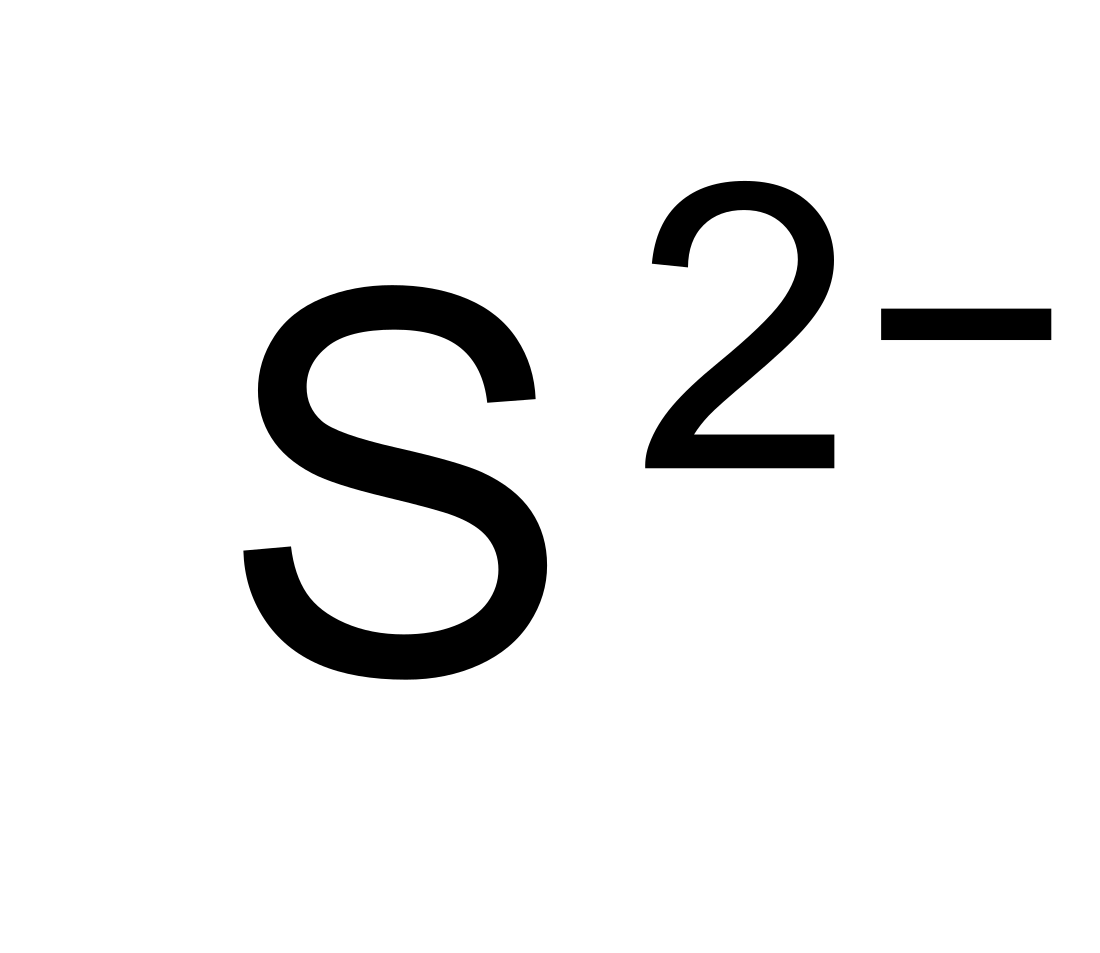无机化学中,硫化物指电正性较强的金属或非金属与硫形成的一类化合物。大多数金属硫化物都可看作氢硫酸的盐。由于氢硫酸是二元弱酸,因此硫化物可分为酸式盐(HS−,氢硫化物)、正盐(S2−)和多硫化物(Sn2−)三类。
| 硫化物 | |
|---|---|
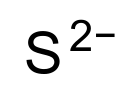
| |
| 系统名 Sulfide(2−)[1] (additive), recommended name Sulfanediide (substitutive),[1] not common, rarely used, sometimes generated by automated nomenclature software in organic chemistry | |
| 识别 | |
| CAS号 | 18496-25-8 |
| PubChem | 29109 |
| ChemSpider | 27079 |
| SMILES |
|
| ChEBI | 15138 |
| 性质 | |
| 化学式 | S |
| 摩尔质量 | 32.07 g·mol−1 |
| 相关物质 | |
| 其他阴离子 | 氧化物 硒化物 碲化物 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
有机化学中,硫化物(英文:Sulfide)指含有二价硫的有机化合物。根据具体情况的不同,有机硫化物可包括:硫醚(R-S-R)、硫酚/硫醇(Ar/R-SH)、硫醛(R-CSH)、硫代羧酸(S取代羧基中的一个或两个O,如R-CO-SH、R-CS-OH、R-CS-SH)和二硫化物(R-S-S-R)等。参见有机硫化合物。
合成
无机硫化物通常可通过以下方法合成:
- 单质直接化合,例如:
- C + 2S -1123~1223K→ CS2
- Na2SO4 + 4C -1373K→ Na2S + 4CO
- In2S3 + 2H2 → In2S + 2H2S
- 溶液中或高温的复分解反应,例如:
- FeCl2 + H2S → FeS↓ + 2HCl
- 3SiO2 + 2Al2S3 -1373K→ 3SiS2 + 2Al2O3
- 以硫代酸盐为原料制取,例如:
- (NH4)2MoO4 + 4(NH4)2S + 4H2O → (NH4)2[MoS4] + 8NH3.H2O
- (NH4)2[MoS4] + 2HCl —Δ→ MoS3 + H2S + 2NH4Cl
- 高价硫化物加热分解,例如:
- MoS3 -△→ MoS2 + S
物理性质
| Al2S3 | 黄 | GeS | 灰黑 | P4S5 | 亮黄 | CdS | 黄 |
| Ga2S3 | 黄 | SnS2 | 黄 | P4S10 | 黄 | HgS | 红/黑 |
| In2S3 | 黄/红 | SnS | 棕黑 | As4S4 | 红 | MnS | 绿/肉 |
| InS | 酒红 | PbS | 黑 | As4S6 | 黄 | MoS3 | 红棕 |
| Tl2S3 | 蓝黑 | As4S10 | 淡黄 | RuS2 | 灰蓝 | ||
| Tl2S | 黑 | Sb2S3 | 橙红 | FeS2 | 黄 | ||
| Bi2S3 | 棕黑 | ||||||
硫化物大多含有鲜艳的颜色,见右表。[2] 除此之外,MoS2、Re2S7、FeS、CoS2、NiS、PtS2、Cu2S、CuS和Ag2S等过渡金属硫化物都是黑色的。
金属的酸式硫化物都可溶于水,但正盐中只有碱金属硫化物和硫化铵可溶。一般地讲,金属硫化物的溶解度可通过阳离子极化力(离子电荷数/离子半径,Z2/r)的大小来预测。阳离子极化能力的增强,将导致化合物共价性的增加,极性减小,因而溶解度也降低。
化学性质
金属硫化物在水中都会发生不同程度的水解:
- S2− + H2O → HS− + OH−
- HS− + H2O ⇌ H2S + OH−
H2S的pKa分别约为:pKa1 = 6.89 和 pKa2 = 19±2,[3] 因此金属硫化物溶液会呈不同程度的碱性,而碱金属的硫化物溶液的碱性更是可以与相应的氢氧化物匹敌。
S2−不能在水中存在,也无法在超高浓度的CsOH溶液中存在。[4]
灼烧硫化物矿物时可能发生两种反应:[5]
- 2PbS + 3O2 → 2PbO + 2SO2
- 硫化物被氧化为相应的可溶硫酸盐。
以上两步都是冶炼金属时,转化硫化物矿石的重要方法。
硫化物中-2价的硫具有还原性,视条件不同可被氧化为硫、亚硫酸盐和硫酸盐等。
- S + 2e− = S2−; -0.407V[6]
硫化物和相应的氧化物类似,其酸碱性随周期和族的变化也和氧化物的类似,但硫化物的碱性不如氧化物强。
| H2S | NaHS | Na2S | As2S3 | As2S5 | Na2S2 |
| H2O | NaOH | Na2O | As2O3 | As2O5 | Na2O2 |
| 碱性 | 碱性 | 两性 | 酸性 | 碱性 |
同周期元素最高氧化态硫化物从左到右酸性增强;同族元素相同氧化态的硫化物从上到下酸性减弱;同种元素的硫化物中,高氧化态的硫化物酸性更强。因此As2S5酸性强于Sb2S5,而Sb2S5的酸性则要强于SnS2和Sb2S3。
多硫化物
多硫化物是含有多硫离子Sn2−的化合物,n=2,3,4,5,6,...,9。多硫化物可由硫在硫化物溶液中煮沸制得,其溶液一般都为黄色,且颜色随n值的增加而加深。
多硫离子类似于过氧化物,具有氧化性,但不及过氧离子氧化性强:
- S22− + 2e− = 2S2−; E
o= -0.476V - HO2− + H2O + 2e− = 3OH−; E
o= 0.87V
- Sn2− + 2H+ → H2S + (n-1)S
分析
应用
硫化氢系统是传统且较广泛的分析阳离子的方法,主要依据各离子硫化物溶解度的显著差异,将常见的阳离子分成五组。
| 组试剂 | HCl | 0.3 mol/L HCl, H2S 或 0.2~0.6 mol/L HCl TAA,加热 |
NH3 + NH4Cl (NH4)2S 或 TAA,加热 |
/ | |
| 组的名称 | I组 银组 盐酸组 |
II组 铜 锡组 硫化氢组 |
III组 铁组 硫化铵组 |
IV组 钙钠组 可溶组 | |
| 组内离子 | Ag+ Hg22+ Pb2+ |
II A Pb2+ Bi3+ Cu2+ Cd2+ |
II B Hg2+ As(III,V) Sb(III,V) Sn(II,IV) |
Al3+ Mn2+ Cr3+ Zn2+ Fe3+ Co2+ Fe2+ Ni2+ |
Ba2+ K+ Ca2+ Na+ Mg2+ NH4+ |
由于H2S气体毒性大,且储存不便,故一般多以硫代乙酰胺(CH3CSNH2,TAA)水溶液作沉淀剂。
- 在酸性溶液中TAA水解产生H2S,可替代H2S:
- CH3CSNH2 + H+ + 2H2O ⇌ CH3COOH + NH4+ + H2S↑
- 在氨性溶液中水解生成HS−,可替代(NH4)2S:
- CH3CSNH2 + 2NH3 ⇌ CH3-C(-NH2)=NH + NH4+ + HS−
- 在碱性溶液中水解生成S2−,可替代Na2S:
- CH3CSNH2 + 3OH− ⇌ CH3COO− + NH3 + H2O + S2−
硫化物的其他应用还有:
参见
参考资料
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.