碳(英语:Carbon;拉丁语:Carbonium,意为“煤炭”),是一种化学元素,化学符号为C,原子序数为6,原子量为7001120110000000000♠12.011 u,位于元素周期表中的IV A族,属于非金属。每个碳原子有四颗能够进行键合的电子,因此其化合价通常为4。自然产生的碳由三种同位素组成:12C和13C为稳定同位素,而14C则具放射性,其半衰期约为5730年。[12]碳是少数几个自远古就被发现的元素之一(见化学元素发现年表)。[13]
 提示
提示:此条目页的主题不是
炭。
Quick Facts 外观, 概况 ...
碳 6C|
|
| 外观 |
|---|
透明(钻石)或黑色(石墨)

钻石(左)和石墨(右)是碳最常见的两种同素异形体。 |
| 概况 |
|---|
| 名称·符号·序数 | 碳(Carbon)·C·6 |
|---|
| 元素类别 | 非金属 |
|---|
| 族·周期·区 | 14·2·p |
|---|
| 标准原子质量 | [12.0096, 12.0116][1] |
|---|
| 电子排布 | [He] 2s2 2p2
2, 4
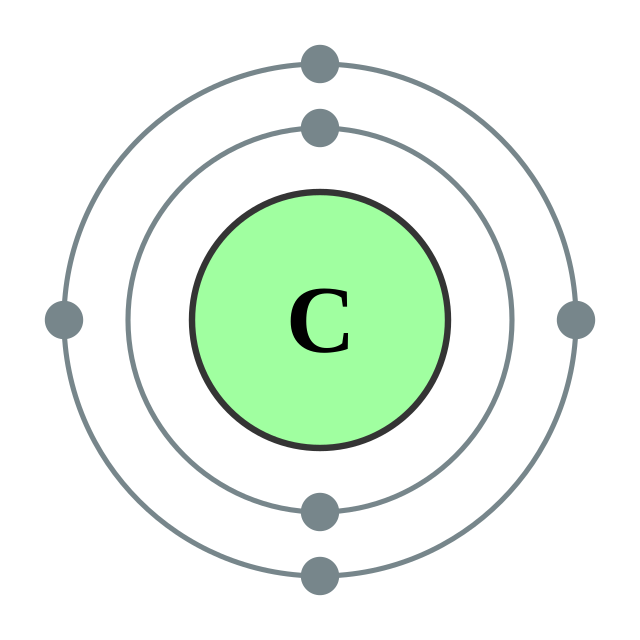 碳的电子层(2, 4) 碳的电子层(2, 4) |
|---|
| 历史 |
|---|
| 发现 | 古埃及人和苏美人[2](公元前3750年) |
|---|
| 确认为化学元素 | 安东万·拉瓦锡[3](1789年) |
|---|
| 物理性质 |
|---|
| 物态 | 固体 |
|---|
| 密度 | (接近室温)
无定形:[4]1.8–2.1 g·cm−3 |
|---|
| 密度 | (接近室温)
钻石:3.515 g·cm−3 |
|---|
| 密度 | (接近室温)
石墨:2.267 g·cm−3 |
|---|
| 升华点 | 3915 K,3642 °C,6588 °F |
|---|
| 三相点 | 4600 K(4327 °C),10800[5][6] kPa |
|---|
| 熔化热 | 117(石墨) kJ·mol−1 |
|---|
| 比热容 | 6.155(钻石)
8.517(石墨) J·mol−1·K−1 |
|---|
| 原子性质 |
|---|
| 氧化态 | 4, 3[7], 2, 1[8], 0, −1, −2, −3, −4[9] |
|---|
| 电负性 | 2.55(鲍林标度) |
|---|
| 电离能 | 第一:1086.5 kJ·mol−1
第二:2352.6 kJ·mol−1
第三:4620.5 kJ·mol−1
(更多) |
|---|
| 共价半径 | 77(sp³), 73(sp²), 69(sp) pm |
|---|
| 范德华半径 | 170 pm |
|---|
 碳的原子谱线 碳的原子谱线 |
| 杂项 |
|---|
| 晶体结构 | 钻石
(钻石,透明)
六方
(石墨,黑色) |
|---|
| 磁序 | 反磁性[10] |
|---|
| 热导率 | 900-2300(钻石)
119-165(石墨) W·m−1·K−1 |
|---|
| 膨胀系数 | (25 °C)0.8(钻石)[11] µm·m−1·K−1 |
|---|
| 声速(细棒) | (20 °C)18350(钻石) m·s−1 |
|---|
| 杨氏模量 | 1050(钻石)[11] GPa |
|---|
| 剪切模量 | 478(钻石)[11] GPa |
|---|
| 体积模量 | 442(钻石)[11] GPa |
|---|
| 泊松比 | 0.1(钻石)[11] |
|---|
| 莫氏硬度 | 10(钻石)
1-2(石墨) |
|---|
| CAS号 | 7440-44-0 |
|---|
| 同位素 |
|---|
主条目:碳的同位素
|
Close
碳的同素异形体有数种,最常见的包括:石墨、钻石及无定形碳。[14]这些同素异形体之间的物理性质,包括外表、硬度、电导率等等,都具有极大的差异。在正常条件下,钻石、碳纳米管和石墨烯的热导率是已知材质中最高的。
所有碳的同素异形体在一般条件下都呈固态,其中石墨的热力学稳定性最高。它们不易受化学侵蚀,甚至连氧都要在高温下才可与其反应。碳在无机化合物中最常见的氧化态为+4,并在一氧化碳及过渡金属羰基配合物中呈+2态。无机碳主要来自石灰石、白云石和二氧化碳,但也大量出现在煤、泥炭、石油和甲烷水合物等有机矿藏中。碳是所有元素中化合物种类最多的,目前有近一千万种已记录的纯有机化合物,但这只是理论上可以存在的化合物中的冰山一角。[15]
碳的丰度在地球地壳中排列第15(见地球的地壳元素丰度列表),并在全宇宙中排列第4(见化学元素丰度),名列氢、氦和氧之下。由于碳元素极为充沛,再加上它在地球环境下所能产生的聚合物种类极为繁多,因此碳是地球上所有生物的化学根本。[16]




