热门问题
时间线
聊天
视角
氫化鈾
化合物 来自维基百科,自由的百科全书
Remove ads
此條目的語調或風格或許不適合百科全書。 (2012年8月22日) |
Remove ads
性質
氫化鈾是一種劇毒的棕褐色至棕黑色,可自燃粉末或脆性固體。 它在 20°C 下的密度是 10.95 g cm−3,大大低於鈾的密度 (19.1 g cm−3)。 它具有金屬導電性,在鹽酸中微溶,在硝酸中分解。
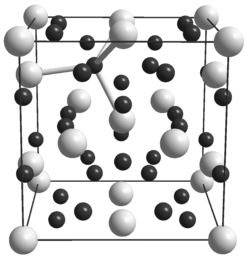
氫化鈾的兩種晶體均為立方晶體:在低溫下獲得的α形式和在溫度高於250℃時產生的β形式。[5] 兩種形式在室溫及低於室溫的溫度下都是亞穩態的,但加熱至100°C時,α形式會緩慢轉變為β形式。[3] 和在低於180K的溫度下均為鐵磁性,高於180K時為順磁性的。[6]
Remove ads
以鈾金屬為原料製備
鈾金屬暴露於氫氣中會導致氫脆。氫在金屬中擴散並在晶粒邊界形成脆性氫化物的網絡。通過真空中的退火可以除去其中的氫並恢復延展性。[7]
金屬鈾加熱到250至300°C(482至572°F)會和氫氣反應,形成氫化鈾。 加熱到 500°C 則會釋放氫氣。 此特性使氫化鈾成為各種鈾的碳化物、氮化物和鹵化物的理想原料,可用於製備反應性鈾粉末。[5] 這個可逆反應如下:[2]
氫化鈾不是間隙化合物,導致金屬在形成氫化物時膨脹。 在其晶格中,每個鈾原子被另外6個鈾原子和12個氫原子包圍;每個氫原子在晶格中占據一個大的四面體孔。[8] 氫化鈾中的氫密度與液態水或液態氫中的氫密度大致相同。[9] 通過氫原子的U-H-U橋鍵存在於結構中。[10]
當鈾金屬暴露在水蒸氣中時,會形成氫化鈾。反應進行如下:
這時產生的氫化鈾是可自燃的;如果此後將金屬(例如:損壞的燃料棒)暴露在空氣中,則可能會產生過多的熱量,並且鈾金屬本身也會燃燒。[11] 通過暴露於98%氦與2%氧的氣體混合物中,可以將被氫化物污染的鈾鈍化。[12] 鈾金屬上的冷凝水促進了氫和氫化鈾的形成;在沒有氧的情況下可以形成可自燃表面。[13] 這給乏核燃料池中的乏核燃料的水下儲存帶來了問題。根據氫化物顆粒的大小和分布,在不確定的暴露時間後會發生自燃。[14] 這樣的暴露帶來放射性廢物儲存庫中燃料碎片自燃的風險。[15]
Remove ads
應用
氫 、氘和氚可通過與鈾反應,然後用熱分解生成的氫化物/氘化物/氚化物來純化。 [17] 數十年來,人們已經從氫化鈾中製備了極其純淨的氫氣。 [18] 加熱氫化鈾是將氫引入真空系統的便捷方法。 [19]
如果粉末狀的氫化鈾發生熱分解,則氫化鈾合成時的溶脹和粉碎可用於製備非常細的鈾金屬。
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

![{\displaystyle {\mathrm {UH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7e9105adf4693cf12dca5a4b59c9a2096455c7a0)
![{\displaystyle {\mathrm {\alpha } {\vphantom {A}}^{-}~\mathrm {UH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/450572db2de624299aef4cb6dbb8d2b09acaa15e)
![{\displaystyle {\mathrm {\beta } {\vphantom {A}}^{-}~\mathrm {UH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/504af11ca02e90462d10686555aeb6cb1e45a7cb)
![{\displaystyle {2\,\mathrm {U} {}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {UH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/73926ab908b5c92432e1bb3da4c6255b1133b0c5)
![{\displaystyle {7\,\mathrm {U} {}+{}6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}3\,\mathrm {UO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}4\,\mathrm {UH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fb16d3f8907d1753434214c5302c07e7bd53005a)