热门问题
时间线
聊天
视角
氣性壞疽
来自维基百科,自由的百科全书
Remove ads
氣性壞疽(Gas gangrene),亦稱為肌肉壞死(Myonecrosis)或梭菌性肌肉壞死(Clostridial myonecrosis),是一種由梭狀芽孢桿菌屬引起的深層軟組織感染,具有高度致命性。其中,產氣莢膜梭菌是最常見的致病菌。[9][5] 這種疾病的特徵是受傷組織快速發展成壞疽,並產生惡臭氣體。
Remove ads
病原學
梭菌感染通常發生在受創傷的組織中,但也可能自發產生。感染涉及較深的組織,例如肌肉,並可能沿著組織層面迅速擴散,病人往往表現出敗血症的症狀。感染可能在最初創傷和細菌接種後的數小時至數週內發展。細菌接種並不一定會導致氣性壞疽,宿主和病原體的因素共同決定了感染是否會進一步發展。免疫功能低下的病人以及局部組織缺氧(由於創傷或血液供應不良)的病人風險最高。引起這些感染最常見的病原體是產氣莢膜梭菌(Clostridium perfringens)、敗毒梭菌(Clostridium septicum)和溶組織梭菌(Clostridium histolyticum)。敗毒梭菌是與消化道異常(如結腸癌)相關的自發性氣性壞疽最常見的原因。產氣莢膜梭菌和溶組織梭菌則更常與創傷後感染有關。[10][11]
近年來,文獻報道了一種不常見的病原體——索氏梭菌(Clostridium sordellii),在使用口服米非司酮和陰道米索前列醇進行藥物人工流產後,引起致命的休克綜合症和子宮氣性壞疽。索氏梭菌也與注射「黑焦油海洛英」有關的感染個案增加有關。此外,這種病原體引致與分娩相關的深層組織感染,以及婦科手術(包括敗血性流產)後的感染也有所增加,這些感染可導致子宮氣性壞疽。[10][12][13]
Remove ads
流行病學
在美國,肌肉壞死的發病率每年僅約1000宗。在醫療資源和抗生素較匱乏的發展中國家,發病率可能更高,但具體數字不詳。即使有最好的護理,包括早期識別、外科處理、抗生素治療和高壓氧治療,總體死亡率仍達20%至30%,部分研究顯示低至5%至10%;然而,若不治療,此病的致死率為100%。宿主因素,如免疫功能低下狀態、糖尿病以及自發性感染,可能導致更高的死亡率,達67%或以上。若感染涉及腹部軟組織或胸壁,死亡率可高達60%,相比之下,四肢感染的死亡率較低,約為5%至30%。[14][15]
病理生理學
產氣莢膜梭菌(C. perfringens)導致了80%至90%的氣性壞疽病例,但其他梭菌屬也可以引起感染。按流行程度排序,它們是:諾維氏梭菌(Clostridium novyi)(40%)、敗毒梭菌(C. septicum)(20%)、溶組織梭菌(C. histolyticum)(10%)、雙發酵梭菌(Clostridium bifermentans)(10%)、謬誤梭菌(Clostridium fallax)(5%)和索氏梭菌(C. sordellii)。這些微生物存在於土壤和有機廢物中,特別是受糞便污染的環境。
如果傷口中存在厭氧的革蘭氏陽性桿菌,並伴有軟組織和肌肉壞死,醫護人員應懷疑是氣性壞疽。這些微生物會產生氣體,可在X光或CT掃描中觀察到。只有約5%被梭菌定植的傷口會發展成感染。因此,宿主因素和細菌接種的解剖位置有助於判斷細菌是否會發展成梭菌性肌肉壞死感染。例如,深層穿透性肌肉傷口,加上宿主免疫功能低下,比免疫系統健康、營養狀況良好的宿主更容易發展成感染。較開放的表層傷口,特別是經過適當清潔和包紮後,相較於深層穿透性傷口或伴有擠壓傷和組織缺血的傷口,感染的可能性較小。[16]
梭菌屬微生物產生α和θ外毒素,這些毒素會造成廣泛的組織損傷。感染可以迅速擴散,在數小時內,病人可能出現嚴重的休克、敗血症甚至死亡。氧氣張力較高的組織(70 mmHg)會抑制微生物的生長,因為梭菌屬是兼性厭氧菌。兼性厭氧菌是指在有氧氣時通過有氧呼吸產生ATP,但在缺氧時可以轉換為發酵的微生物。如果組織的氧氣張力低於30 mmHg,梭菌屬微生物會生長得更快。感染的發展速度可以很慢(數週)或很快(數小時),取決於組織的氧氣張力和接種的微生物數量。[17]
微生物的毒力取決於其產生的外毒素;產氣莢膜梭菌最具致病性,已知有17種毒素,其中毒性最強的是α-毒素,一種卵磷脂酶。α-毒素是一種磷脂酶(卵磷脂酶),能分解細胞膜,引發血小板聚集、血栓形成和組織胺釋放。此外,還存在膠原酶、透明質酸酶、血凝素和溶血素。θ-毒素直接造成血管損傷和白血球分解,導致宿主對感染的炎症反應減弱。膠原酶分解結締組織,使微生物能夠迅速跨越組織層面擴散。這是感染能夠穿過結締組織層面,擴散到更深層肌肉組織的主要原因之一。[12][18][19]
病徵與臨床表現

(a) 水腫性腸壁的宏觀圖像,可見多個黏膜下層及漿膜下層囊腫
(b) 腸道黏膜的組織病理學圖像,顯示非反應性壞死
(c) 囊腫的革蘭氏染色,顯示大型桿狀細菌
(d) 黏膜下囊腫中發現的細菌的電子顯微鏡圖像

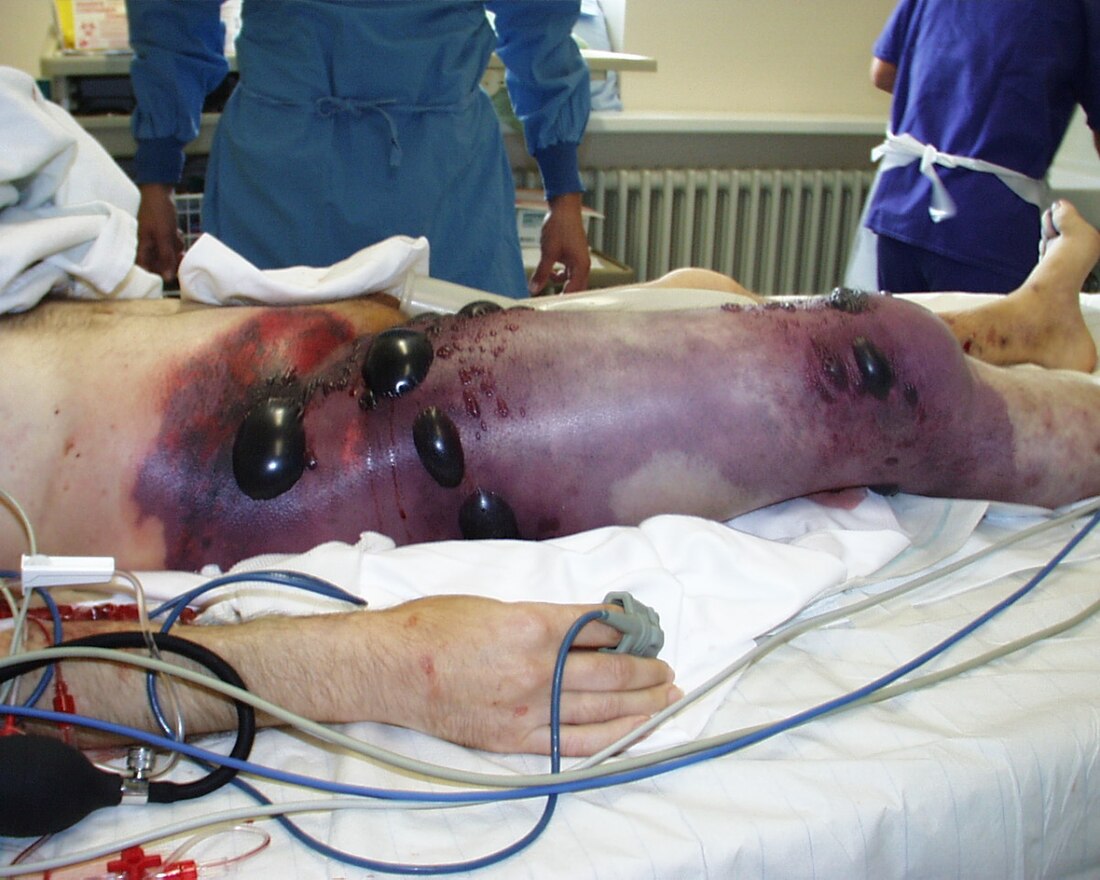
患有氣性壞疽(肌肉壞死)的病人會出現感染跡象,如發燒、發冷、疼痛。然而,相較於這些感染的深層穿透性質,感染部位的表層炎症反應可能不如預期般嚴重。如果不積極治療,病人的狀況可能迅速惡化至敗血症甚至死亡。傷口分泌物通常呈「洗碗水」樣(dishwater-looking),帶有霉味。感染可能波及供應大面積受感染組織的血管,導致皮下脂肪壞死,向下延伸至筋膜並進入更深的肌肉層。如果神經受損,疼痛的嚴重程度可能低於感染範圍所預期的程度。壞死組織的引流物常呈洗碗水樣外觀,並帶有霉味。嚴重敗血症的跡象包括敗血性休克、成人呼吸窘迫綜合徵(ARDS)、瀰漫性血管內凝血(DIC)和溶血,後者可能導致溶血性貧血,這也常是病人就診時的表現。任何患有蜂窩組織炎的病人,如果出現因組織內氣體引起的骨擦音,以及皮膚呈壞死或暗紫色外觀,都應評估是否患有氣性壞疽。[1][2][3]
Remove ads
組織病理學
毒物動力學
產氣莢膜梭菌產生的常見毒素:[20]
- α-毒素: 卵磷脂酶(或磷脂酶),分解細胞膜,導致細胞死亡和組織壞死。此毒素也具有溶血性和心臟毒性。
- β-毒素: 引起組織壞死。
- δ-毒素: 溶血素。
- ε-毒素: 增加細胞膜通透性;通透酶。
- ι-毒素: 引起組織壞死。
- κ-毒素: 膠原酶、明膠酶,引起組織壞死。特別破壞血管和結締組織。
- λ-毒素: 蛋白酶。
- μ-毒素: 透明質酸酶。
- ν-毒素: 脫氧核糖核酸酶,具有溶血性和引起組織壞死。
- φ-毒素: 溶血素、細胞溶解素。
評估
對懷疑患有氣性壞疽的病人,應立即進行的檢查包括:全血細胞計數、全套代謝檢查(CMP)、尿液分析、凝血酶原時間、活化部分凝血活酶時間(APTT)、血液和傷口細菌培養。其他血液測試如動脈血氣分析(ABG)、乳酸和降鈣素原有助於評估敗血症,這在氣性壞疽中很常見。常用的影像學檢查包括受感染部位的X光、CT掃描和超聲波。這些檢查有助於確定感染範圍、膿瘡和組織中的氣體。然而,詳盡的實驗室檢查和影像學檢查不應延誤對壞死組織的決定性外科清創術。在初次外科清創期間,進行深層傷口的需氧和厭氧培養有助於確定致病微生物,並指導抗生素治療。[6]
治療與處理
由於氣性壞疽感染進展迅速,必須積極治療病人,措施包括使用抗生素、早期外科會診及清創、靜脈輸液復甦、深切治療部監測,以及輔助性的高壓氧治療(HBOT)。及早進行外科會診至關重要,因為這是一種真正的外科急症,不應有任何延誤。醫護人員不應為了等待培養結果而延遲使用抗生素,應立即開始經驗性治療。合理的廣譜抗生素覆蓋包括萬古霉素、他唑巴坦、碳青黴烯類抗生素,或頭孢曲松聯合甲硝唑。如果懷疑是氣性壞疽或壞死性筋膜炎,應加用青黴素加克林黴素,以覆蓋A群鏈球菌引起的壞死性筋膜炎。強烈建議使用克林黴素,因為它能抑制梭菌外毒素的合成,減輕這些毒素的全身性影響。由於克林黴素是抑菌劑而非殺菌劑,應與第二種抗菌藥物(如青黴素)聯合使用。[21][22][23][8][24]
可能需要進行筋膜切開術以緩解腔室壓力。隨著感染沿著筋膜下及深層組織擴散,腔室壓力會增加,進一步加劇組織缺血和壞死。外科清創應著重於清除所有壞死組織和異物,如泥土、碎屑和彈片。用大量無菌生理鹽水沖洗傷口也很重要。在高標準的抗生素和外科清創治療基礎上,應加用高壓氧治療以提高存活率。[24][25] 協調這些危重病人的護理至關重要,需要重症醫學科醫生、普通外科醫生、骨科醫生、泌尿科醫生(若涉及睪丸和會陰結構的福尼爾氏壞疽)、婦科醫生(若涉及子宮氣性壞疽)、感染科專科醫生、血液學/腫瘤學醫生、腸胃科醫生(若涉及自發性氣性壞疽)以及高壓氧治療專家的共同參與。會診流程通常由急症室醫生開始,並需及早識別疾病。[26][27][26]
早期靜脈注射抗生素、早期外科清創,隨後進行高壓氧治療,可以挽救患有這種幾乎總是致命的疾病的病人。靜脈注射抗生素和早期外科清創可將死亡率降至約30%。高壓氧治療可將此數字進一步降至5%至10%。高壓氧治療通過阻止細菌產生外毒素、增強抗生素的殺菌效果、治療組織缺血、改善組織的再灌注損傷,以及促進幹細胞和多形核白血球的活化與遷移來發揮作用。此外,高壓氧會誘導血管收縮,減少組織水腫,同時增加氧合作用。組織的氧氣張力增加1000倍,這種增加的氧氣有助於解決缺氧問題、改善細胞活性、抑制細菌生長,並影響細胞因子的產生,從而增加嗜中性球向受損組織的遷移。高壓氧還能增加血管內皮生長因子等生長因子的產生,誘導血管新生和組織修復,促進毛細血管萌芽。這在臨床上表現為肉芽組織形成的增加,通常在數次高壓氧治療後可見。[28][29][30][29]
高壓氧治療是將病人置於加壓艙內進行,可以是單人艙(mono-place,一次治療一名病人)或多人艙(multi-place,可同時治療多名病人)。單人艙一次只能治療一名病人,醫護人員在艙外通過艙門或艙壁上的接口操作專門設備和泵來進行靜脈輸液甚至機械通氣。這種設置的缺點是限制了艙內可進行的治療。如果病人需要醫護人員直接接觸,則必須減壓並將病人移出艙外。多人艙的優點是可以同時治療多名病人,且醫護人員與病人同在艙內,更方便進行呼吸機支持、靜脈治療、放置胸腔引流管或對氣胸進行針刺減壓術。治療氣性壞疽的壓力為3絕對大氣壓(ATA)。為降低氧中毒風險,病人每半小時需進行一次「空氣間歇」(air break),通常持續5至10分鐘。壓力下的治療時間通常約為90分鐘,下降(加壓)和上升(減壓)各需10分鐘。[26][31][32][26]
治療氣性壞疽時,最初的5到10次治療每天進行兩次,待病情穩定後減至每天一次。在初步穩定後繼續進行高壓氧治療,可以加速組織癒合,為最終的組織移植做準備,這通常是閉合清創術後留下的大面積缺損所必需的。高壓氧治療的風險包括氧中毒(可能引起癲癇發作)、低血糖(尤其是在胰島素依賴型糖尿病病人中)和氣壓傷(可能影響耳朵、肺部或任何充滿氣體的結構,如胃部)以及氣體栓塞。這些併發症很少見,除了耳部氣壓傷,其發生率約為43%(其中84%是輕微的鼓膜充血)。[33]
重要的是,在處理氣性壞疽時,必須立即尋求外科會診,不得延誤,因為這是一個緊急情況。應立即開始使用廣譜抗生素,無需等待培養結果。合理的覆蓋應包括萬古霉素、他唑巴坦、碳青黴烯類抗生素,或第三代頭孢菌素(如頭孢曲松)聯合甲硝唑。此外,若懷疑是氣性壞疽或壞死性筋膜炎,應加用青黴素加克林黴素以覆蓋A群鏈球菌。強烈建議使用克林黴素。高壓氧治療是氣性壞疽的輔助治療措施之一。然而,高壓氧治療不影響已存在毒素的功能,因此清創術至關重要。血流動力學不穩定的病人可能不適合接受高壓氧治療。此外,動物實驗研究未能證明高壓氧的治療效果。[34][25] 一旦通過充分的外科清創控制了持續的組織壞死,應考慮使用負壓傷口治療(Negative pressure wound therapy)。
Remove ads
鑑別診斷
氣性壞疽的鑑別診斷包括:[7]
術後及復康護理
氣性壞疽病人需要每日或重複進行外科清創,直到壞死性感染得到控制,並接受每日兩次的高壓氧治療,直到組織壞死停止並出現肉芽組織形成的恢復跡象。病人還需要持續的深切治療,可能需要血液透析(若出現腎衰竭)或體外膜氧合(若出現嚴重成人呼吸窘迫綜合徵)。感染消退後,許多病人需要進一步的傷口護理,通常包括負壓傷口治療、先進的組織再生技術以及整形外科手術(如植皮和皮瓣手術)來閉合手術傷口。許多氣性壞疽病人需要長時間入住深切治療部,隨後進行長期康復以提高生存率和恢復功能。許多病人需要轉移到長期護理機構,接受持續的傷口護理、有時是高壓氧治療,以及包括物理治療和職業治療的康復計劃。[35][36]
為了提高氣性壞疽病人的生存率並減少發病率,如果病人出現感染跡象,伴有組織壞死、敗血症,或組織中存在氣體,應高度懷疑此診斷。早期診斷、立即會診外科進行緊急清創,並將病人轉移到有能力護理此類危重病人的設施至關重要。這些病人需要外科、深切治療部和高壓氧/傷口護理團隊之間的協調護理。[37][38]
最佳的治療效果來自於多個專科之間的協調護理,以及在具備護理危重病人能力的設施中進行深切治療。護理工作必須在執行清創的外科醫生、傷口護理/高壓氧治療提供者和深切治療部醫生之間進行協調。在電子健康紀錄中使用照片記錄有助於改善護理協調。外科團隊可以在手術室拍照,傷口護理團隊也可以在更換敷料時拍照。這有助於護士和其他專科(如整形外科和感染科)了解病情進展,並指導決策。康復應在病人情況允許時盡早開始,以減少血栓和肌肉萎縮的風險。團隊的努力必須協調一致,確保每個人對預期結果有共同的理解。需要進行同行評審和團隊績效評估,以非敵對和支持性的方式改進病人護理,使所有團隊成員都能夠並願意為改善病人護理做出貢獻。[1][39][40]
Remove ads
其他圖像
-
因氣性壞疽進行的半骨盆切除術
-
顯微鏡下觀察的肌肉活檢(蘇木精-伊紅染色,放大100倍):肌肉纖維間的大片白色區域是由於氣體形成所致。
-
肩部氣性壞疽。
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads