热门问题
时间线
聊天
视角
硫的同素异形体
来自维基百科,自由的百科全书
Remove ads
硫有著大量的同素異形體,其數量只是僅次於碳。[1]除了有很多同素异形体,每个同素异形体通常还有各种同质异形体(相同结构的硫分子的不同晶体结构),由希腊字母前缀(α、β 等)区分。[2]
此條目需要擴充。 (2012年11月30日) |

此外,由于硫元素几个世纪以来一直都是一件商品,它的各种同素异形体都被赋予了传统名称。早期的工人发现了一些后来被证明是硫的单一或混合的同素异形体。某些形式以其外观命名,例如 “珍珠硫之母”,或者以在鉴定它们的方面非常杰出的化学家命名,例如 “Muthmann硫I”或“Engel硫”。[2][3]
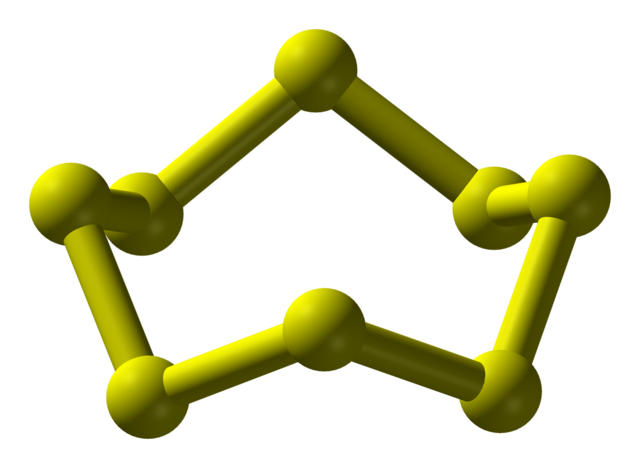
最常见的硫形式是 S
8 的正交晶系同质异形体,为褶皱环结构(见右图)。S8还有另外两种同质异形体,也具有几乎相同的分子结构。[4]除了 S8,以外,含有 6、7、9–15、18 和20个原子的硫环也是已知的。[5] 在五种高压同素异形体中,有两种有金属性。[6]
硫的同素异形体的数量反映了相对较强的S-S键,键能 265 kJ/mol。[7]此外,与大多数元素不同,硫的同素异形体可以在有机溶剂中进行处理,并且可以通过HPLC进行分析。[8]
Remove ads
氣態同素異形體
二硫为硫的双原子分子。在720°C,硫主要以二硫存在。在530°C、低壓(1毫米水銀)的環境中,硫蒸气佔99%是二硫。火焰中產生的S2分子使硫燃燒時呈藍色。[1]
在硫蒸汽存在。根據理論計算的最新觀點認為四硫有著環狀結構。[9]
尚未分離,只在硫蒸汽偵測到。[10]
固體環狀結構
S6的晶形為菱面體,為橙红色固體,首次透過下列反應发现于1891年。
這是由含S6和S10的二硫化碳中之溶液製備所得。
為亮黄色固体,有α、β、γ、δ四种结构。環七硫的環有著不尋常幅度的鍵長(199.3–218.1 pm),因此被認為是最不穩定的同素異形體。

α-硫是硫自然界中最常見的形式,[1]其純淨時的顏色是黃綠色(市面上出售的硫因為有著微量的环七硫而呈現更黃的顏色)。α-硫實際上不溶於水,導熱性能差,為一良好的電絕緣體。此是硫由二硫化碳結晶而得之緊密的黃色晶體,熔點112.8度。
融化硫於部分凝固後,倒出多餘液體,剩下無數之針形晶體即為單斜硫,融點119.2度。
為沸騰之硫注入冷水所得之軟黏體,有彈性。
发现于1890年,为融化硫由二硫化碳缓慢結晶而成。

這些同素異形體是由多種方法合成,例如 可以透过二氯化硫(Sn-mCl2)和H2Sm反應,即
Sn−mCl2 + H2Sm → cyclo-Sn+2 HCl[1]
制取。S12、S18、S20可以由S8製得,其中S12是繼S8後最穩定的環狀同素異形體。S9有4種形式,S18則有2種。
固體連鎖硫結構
生產純淨的連鎖硫已被證明是極其困難的。
亦稱「纖維硫」或ω1-硫[10],其密度為2.01 g·cm−3,會在其融點104°C附近分解。
亦稱ω2-硫。
連續硫形式
這是硫在160°C以上時融解的淬火產物。
此為融化後熔融的硫的名字,冷卻此主要給出β-硫。[10]
把硫加热至170°C可形成S∞。
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
