From Wikipedia, the free encyclopedia
La pressió osmòtica, simbolitzada , és la diferència de pressions que hi ha entre els dos costats d'una membrana semipermeable que separa dues dissolucions de concentracions diferents quan el sistema assoleix l'equilibri.[1]

Quan una dissolució es posa en contacte amb el dissolvent a través d'una membrana semipermeable, membrana que només deixa passar les molècules de dissolvent però no pas les dels soluts, les molècules de dissolvent es difonen cap a la dissolució, aquest fenomen s'anomena osmosi.[2] La paraula «osmosi» deriva del grec ώσμóς, 'impuls'.[3]
La pressió osmòtica és una de les quatre propietats col·ligatives de les solucions, que són propietats que només depenen de la quantitat de partícules en dissolució sense importar la seva naturalesa. I és una de les principals característiques que s'han de tenir en compte en les relacions dels líquids que constitueixen el medi intern d'un ésser viu. La membrana cel·lular determina un comportament que conté solucions de diferent concentració al medi extracel·lular que l'envolta, creant una barrera de control de solut.
Es considera que la dissolució està en equilibri quan el dissolvent deixa de desplaçar-se de la part menys concentrada a la que ho està més. Això succeeix en el cas particular al qual la pressió externa sobre la dissolució i la pressió que exerceix el dissolvent sobre la membrana són idèntiques, aquesta pressió es coneix com a pressió osmòtica i es representa amb la lletra grega . La pressió externa sobre la dissolució és en principi l'atmosfèrica, però podem modificar-la, per a forçar un equilibri, aplicant una pressió addicional, en aquest cas, per a , es considera la suma de la pressió atmosfèrica existent més la pressió exterior aplicada. Es pot arribar a una situació d'equilibri contrarestant aquesta tendència mitjançant l'aplicació d'una certa pressió sobre la dissolució. Per a dissolucions diluïdes i situacions d'equilibri es compleix l'equació de Van 't Hoff:[4]
on:
A la figura adjunta es representen una dissolució concentrada (hipertònica) separada d'una dissolució diluïda (hipotònica), o de dissolvent pur, per una membrana semipermeable. Les molècules de dissolvent passen de la dissolució diluïda a la dissolució concentrada, de manera que el volum de la dissolució concentrada augmenta al mateix temps que es dilueix. Si l'excés de dissolvent es deixa pujar per dins d'un tub capil·lar, com es mostra a la figura, s'assolirà un equilibri quan l'augment de la pressió hidroestàtica, proporcional a l'altura h iguali a la pressió de la dissolució diluïda per passar cap a la dissolució concentrada, la pressió osmòtica. S'impedirà així el pas de més dissolvent cap a la dissolució concentrada. Si s'atura el moviment de líquid d'un lloc a un altre és perquè hi ha un equilibri. Suposem un punt situat sobre la membrana quan s'ha assolit l'equilibri situat a una profunditat y respecte de la part superior del recipient. Aquest punt estarà sotmès a una pressió per l'esquerra i una altra per la dreta que seran iguals. La de l'esquerra correspon a la pressió hidroestàtica deguda a la profunditat, y, més la pressió hidroestàtica deguda a l'altura h de la dissolució dins del tub capil·lar. A la part de la dreta també hi ha la pressió hidroestàtica deguda a la profunditat, y, més, necessàriament, una altra pressió, :
A partir d'aquesta igualtat podem determinar experimentalment la pressió Π perquè és igual a la pressió hidroestàtica produïda per l'altura de la dissolució dins del tub capil·lar:
La pressió osmòtica es mesura amb les mateixes unitats que les pressions en general, és a dir, en pascals (Pa), segons el Sistema Internacional, o tradicionalment, també, en atmosferes (atm). La molaritat mesura la quantitat de massa de solut per a un volum de dissolució. Un augment o disminució de molaritat fa augmentar o disminuir proporcionalment la pressió osmòtica, i a la inversa. De la mateixa manera un augment o disminució de la temperatura (mesurada en kèlvins) augmenta o disminueix la pressió osmòtica. A continuació hi ha una taula amb valors de la pressió osmòtica per a diferents concentracions de sacarosa a 293 K (la concentració s'expressa en molalitat i no en molaritat, segons l'equació de Morse, però les diferències són mínimes).
| Pressió osmòtica observada de dissolucions de sacarosa a 20 °C[5] | |||||||
| Molalitat (g sacarosa/kg aigua) | 0,1 | 1,0 | 2,0 | 3,0 | 4,0 | 6,0 | |
|---|---|---|---|---|---|---|---|
| Pressió osmòtica (atm) | 2,47 | 27,2 | 58,4 | 95,2 | 139,0 | 232,3 | |
Podem comparar la magnitud de la pressió osmòtica amb la de la pressió hidroestàtica. La pressió hidroestàtica ve donada com hem vist per l'equació:
on ρ és la densitat del líquid (ρaigua = 1 000 kg/m³), g és l'acceleració de la gravetat, 9,81 m/s², i h és la profunditat en metres. Per a una profunditat de 10 m la pressió hidroestàtica és de:
Així la primera pressió osmòtica que figura a la taula, 2,47 atm, corresponent a una dissolució 0,1 molal, és igual a la pressió hidroestàtica d'una profunditat dins l'aigua d'uns 25 m. La corresponent a una concentració molal d'1,0 m, és equivalent a la pressió hidroestàtica d'una profunditat d'uns 275 m. Un valor força elevat.

Les primeres investigacions sobre la pressió osmòtica consta que es realitzaren el 1748 per part de l'abat francès Jean Antoine Nollet, professor de física a París. Nollet obtingué una membrana d'una bufeta de porc, col·locant alcohol d'un costat i aigua de l'altre, i observà que l'aigua fluïa a través de la bufeta per a mesclar-se amb l'alcohol, però de cap manera l'alcohol es mesclava amb l'aigua. Així Nollet descobrí l'existència de membranes semipermeables, ja que permetien el pas d'un dels components d'una dissolució i evitava la difusió d'altres.
Però el veritable descobriment de l'osmosi en membranes semipermeables fou realitzat pel francès Henri Dutrochet, considerat com un dels grans fisiòlegs del segle xix, l'any 1828.[6] Dutrochet descobrí el fenomen de l'osmosi quan observà que la difusió del dissolvent a través d'una membrana semipermeable ocorria sempre de la dissolució de menor concentració d'un solut, que no pot passar, cap a la dissolució de major concentració; a més, el dissolvent que flueix és capaç de desenvolupar una pressió sobre la membrana a la qual denominà pressió osmòtica. Dutrochet construí el primer dispositiu experimental per a observar la presència de la pressió osmòtica, anomenat osmòmetre.[7]
L'anglès Thomas Graham descobrí, el 1854, que les substàncies col·loïdals no passen a través de certes membranes. Però els primers estudis quantitatius daten de 1877[8] i es deuen a l'alemany Wilhelm Pfeffer, professor de botànica a Tubingen i a Leipzig, el qual preparà una membrana semipermeable precipitant hexacianoferrat (II) de coure (II), Cu₂[Fe(CN)₆], damunt les parets d'un vas porós.[9] Pfeffer, a partir de les dades de moltes determinacions de pressions osmòtiques amb dissolucions de soluts no volàtils, arribà a les següents conclusions:
L'holandès Jacobus Henricus van 't Hoff realitzà un estudi sistemàtic de les propietats col·ligatives de les dissolucions que publicà el 1885.[10] En aquest article donà una expressió, per a dissolucions diluïdes, que relaciona la pressió osmòtica amb la concentració del solut que és semblant a l'equació del gasos ideals i proporcionà la primera teoria per explicar la pressió osmòtica:

S'han proposat diverses teories per explicar la causa de l'osmosi. La primera teoria és la del bombardeig de Van 't Hoff i està basada en l'analogia entre l'equació de la pressió osmòtica i la llei dels gasos ideals. Van 't Hoff descrigué la pressió osmòtica com el resultat de col·lisions de les molècules del solut contra la membrana semipermeable, i suposà que les molècules del dissolvent no contribueixen de cap forma. Amb aquest model, la pressió osmòtica d'una dissolució és la mateixa pressió que un gas ideal exerciria si ocupàs el mateix volum de la dissolució.
La suposició que les molècules del dissolvent no exerceixen cap efecte constitueix un interrogant, ja que aquestes molècules estan contínuament colpejant la membrana semipermeable. Una altra teoria considera el bombardeig de les molècules del dissolvent. Així, l'osmosi i la pressió osmòtica resulten d'un bombardeig desigual de les molècules del dissolvent sobre la membrana semipermeable. Segons aquesta teoria, les molècules de solut són les causants d'aquest bombardeig desigual, i la diferència en la pressió del dissolvent augmenta en incrementar-se les quantitats de solut.
Una tercera teoria explica l'osmosi a partir del descens de la pressió de vapor, el qual dona lloc que el dissolvent destil·li a través de la membrana fins que s'igualen ambdues pressions. Si apliquem una pressió igual a la pressió osmòtica de la dissolució s'aturarà la destil·lació, i necessitaríem una pressió major per invertir la direcció.[11][9] El flux de dissolvent a través d'una membrana semipermeable és anàleg al flux de dissolvent en la fase vapor que es produeix si es deixen dintre d'un recipient tancat mostres del dissolvent i d'una dissolució. Com que la pressió de vapor del dissolvent és major, es produeix una transferència neta de dissolvent cap a la dissolució. El flux de dissolvent continua fins que tot el dissolvent ha passat a la dissolució.[12]
Des d'un punt de vista termodinàmic es pot relacionar la pressió osmòtica amb l'entropia per explicar el sentit del flux del dissolvent. El pas de dissolvent cap a la dissolució representa un augment de l'entropia del sistema. Les molècules de solut augmenten el seu desordre en diluir-se la dissolució per l'arribada de més dissolvent, ja que les molècules de solut tenen més espai per on moure's, la qual cosa representa més desordre i, per tant, una major entropia. També les molècules de dissolvent tenen major desordre en una dissolució que en el dissolvent pur. Si el dissolvent passés des de la dissolució al dissolvent pur hi hauria un augment de l'ordre, s'anirien separant solut de dissolvent, cosa que estaria en contra del segon principi de la termodinàmica.[12] Això és demostrable matemàticament.
En el cas de dissolucions diluïdes de no electròlits s'aplica directament l'equació de Van 't Hoff. Si la pressió osmòtica es produeix entre dues dissolucions, en lloc d'entre una dissolució i el dissolvent pur, a l'equació hi figura la diferència de concentracions, ∆c:
Més ajustada a les observacions experimentals de la pressió osmòtica és l'equació obtinguda pel químic nord-americà Harmon Northrop Morse, el qual va substituir la concentració expressada en molaritat de l'equació de Van 't Hoff per l'expressada en molalitat, m.[13] És l'equació de Morse:
Si cal ser precisos l'equació de Morse expressada en molalitat només és correcte si el dissolvent és aigua, ja que coincideix el volum de l'aigua expressat en litres amb la seva massa expressada en quilograms.
Quan s'arriba a l'equilibri la pressió a la dissolució és major que la pressió en el dissolvent en una quantitat Π. Tindrem doncs un equilibri:
El potencial químic de la dissolució es pot posar en funció del potencial químic del dissolvent i de la seva fracció molar, quedant l'anterior equació:
que podem reorganitzar:
El segon membre correspon a la diferència de potencials químics del dissolvent pur a dues pressions diferents que es pot relacionar amb el seu volum molar, amb l'equació:
Ara podem fer diverses aproximacions:
Aproximació 1) Suposarem constant el volum molar:
Igualant les equacions anteriors queda:
Podem aïllar la pressió osmòtica i queda:
Aproximació 2) Podem posar la fracció molar del dissolvent en funció de la fracció molar del solut: x1 = 1 - x₂ i desenvolupar el ln(1 - x₂) amb una sèrie de Mclaurin i ens quedarem només amb el primer terme:
L'equació ens queda ara en funció de la fracció molar del solut:
Aproximació 3) Podem posar la fracció molar en funció del nombre de mols de solut i dissolvent. Es poden negligir els mols de solut en el denominador enfront dels mols de dissolvent:
Podem substituir a l'equació de la pressió osmòtica:
i el producte del volum molar pels mols de dissolvent és el volum del dissolvent. S'obté l'equació de Morse:
Aproximació 4) Per a una dissolució diluïda el volum del dissolvent coincideix pràcticament amb el volum de la dissolució:
La fracció n₂/V correspon a la concentració molar de la dissolució, c₂. I finalment obtenim l'equació de Van 't Hoff:
[2]Jacobus Henricus van 't Hoff descobrí que les dissolucions d'electròlits no complien l'equació de la pressió osmòtica per a dissolucions de no electròlits, i introduí l'anomenat factor de Van 't Hoff, un factor empíric simbolitzat per i, i definit com el quocient entre el valor experimental de la pressió osmòtica mitjana i el valor teòric que es dedueix amb l'equació.
D'aquesta manera la nova equació per a la pressió osmòtica prengué la forma:
El factor i fou explicat pel químic suec Svante August Arrhenius quan desenvolupà entre 1883 i 1887 la teoria de la dissociació electrolítica,[14] segons la qual les molècules dels electròlits es dissocien en major o menor extensió en ions carregats elèctricament, capaços de transportar el corrent elèctric, i existint un equilibri entre les molècules no dissociades i els ions. Per tant, en dissolució hi ha més partícules que les que s'han dissolt, ja que aquestes es rompen, es dissocien, en parts més petites. La pressió osmòtica, com les altres propietats col·ligatives, depèn del nombre total de partícules en dissolució, de manera que en una dissolució d'electròlits tendrem més partícules que les dissoltes, les quals s'han de tenir en compte per a calcular la concentració total. Per exemple podem suposar un electròlit binari com el clorur de calci, CaCl₂, el qual assoleix l'equilibri de dissociació en aigua segons la següent equació:
En dissolució, per tant, hi ha més partícules que les dissoltes inicialment perquè part d'aquestes s'han dissociat en ions.[2]
Per a dissolucions concentrades, s'ha de fer ús de les activitats en lloc de les fraccions molars i s'ha de tenir en compte la influència de la pressió en el volum molar del dissolvent (a la deducció termodinàmica es considera el volum del dissolvent constant). D'aquesta manera s'aconsegueix una expressió més precisa aplicable a les dissolucions concentrades que conté un terme afegit on apareix la pressió osmòtica al quadrat:
on κT,1 és el coeficient de compressibilitat isoterm del dissolvent.[2]
Quan s'arriba a l'equilibri, la pressió a la dissolució és major que la pressió en el dissolvent en una quantitat Π. S'obté un equilibri:
El potencial químic de la dissolució es pot posar en funció del potencial químic del dissolvent i de la seva activitat molar, quedant l'anterior equació:
que podem reorganitzar:
El segon membre correspon a la diferència de potencials químics del dissolvent pur a dues pressions diferents que es pot relacionar amb el seu volum molar, amb l'equació:
El volum molar es pot posar en funció del coeficient de compressibilitat isoterm del dissolvent, κT,1:
Integrant queda:
Igualant el resultat obtingut aquí amb el primer membre de l'equació [1] tenim:
Podem aïllar el logaritme de l'activitat i queda:
En el cas d'electròlits el coeficient d'activitat del dissolvent roman proper a la unitat encara que la concentració de l'electròlit sigui alta i, per tant, amb coeficients d'activitat de l'electròlit allunyats de la unitat. Per això el coeficient d'activitat del dissolvent no resulta massa adequat per a caracteritzar les propietats reals de la dissolució electrolítica concentrada i es definí el coeficient osmòtic per part del químic danès Niels J. Bjerrum de la següent manera:
d'on s'obté la definició de coeficient osmòtic com la relació entre els logaritmes de l'activitat i de la fracció molar:
L'expressió de la pressió osmòtica per electròlits queda ara corregida amb el coeficient osmòtic:[2]

L'osmosi té una gran importància en els éssers vius. Les cèl·lules dels organismes estan envoltades per fluids aquosos, com ara la sang, la limfa o la saba, que contenen concentracions de diferents soluts. Les membranes cel·lulars són permeables a l'aigua, a l'oxigen, O₂, al nitrogen, N₂, al diòxid de carboni, CO₂ i a petites molècules orgàniques, com glucosa, aminoàcids, etc., mentre que són impermeables a molècules polimèriques, com proteïnes i polisacàrids. En canvi, els ions inorgànics i els disacàrids, com ara la sacarosa, passen molt lentament a través de les membranes cel·lulars.
Les cèl·lules també tenen capacitat de transportar espècies químiques a través de la seva membrana des d'una regió de baixa concentració de l'espècie a una regió de concentració més elevada, en sentit contrari al del flux espontani. Els mecanismes que originen aquest tipus de transport, anomenat transport actiu, són complexos i encara no de tot coneguts. Un exemple típic de transport actiu és el de cations potassi, K+, cap a l'interior de les cèl·lules des dels seus líquids circumdants, que tenen menor concentració de cations potassi.

En l'absència de transport actiu, la membrana cel·lular permet el pas de molècules d'aigua i de tots els soluts permeables fins que s'igualen els seus respectius potencials químics en ambdós costats de la membrana. Això no obstant, existeix un gran nombre d'espècies, tant el fluid que envolta la cèl·lula com en el fluid o citoplasma cel·lular, que no poden travessar la membrana. Si la concentració total d'aquest soluts és més gran en el fluid que envolta la cèl·lula, aquesta perdrà aigua per osmosi i es diu que el fluid circumdant és hipertònic respecte al fluid cel·lular (té major pressió osmòtica). En el cas contrari, quan la concentració total del solut que no pot travessar la membrana és més gran en el fluid de la cèl·lula, aquesta guanyarà aigua del líquid hipotònic circumdant (de menor pressió osmòtica). Quan no es produeix transferència neta d'aigua entre el fluid cel·lular i el que envolta la cèl·lula, es diu que ambdós fluids són isotònics, és a dir, tenen la mateixa pressió osmòtica. La sang i la limfa són aproximadament isotòniques respecte de les cèl·lules d'un organisme.
Els líquids dels injectables contenen una dissolució salina isotònica amb la sang, perquè si s'injectés directament aigua, el leucòcits de la sang l'absorbirien per osmosi fins que esclatessin.[4]

Hi ha unes cèl·lules especialitzades en detectar canvis de la pressió osmòtica en els líquids corporals (plasma sanguini, fluid intercel·lular…), són els osmoreceptors. Aquestes cèl·lules es localitzen a l'hipotàlem, a les artèries i en altres llocs. Mitjançant aquestes cèl·lules l'organisme pot regular la concentració de sals en els seus fluids, la osmolalitat.[15] En els humans són osmoreceptors els nuclis supraòptic i paraventricular. Mitjançant hormones antidiürètiques (vasopressina o ADH, pitressina), els osmoreceptors inhibeixen la diüresi per tal de mantenir la pressió osmòtica de la sang corresponent a una osmolalitat mitjana de 285 mosmol/kg. És suficient una variació en només 3 mosmol/kg per activar aquest mecanisme.[16]

Els vegetals utilitzen la pressió osmòtica per fer ascendir l'aigua a través del xilema des de les rels cap a les fulles. Així s'ha comprovat en els aurons quan comença la primavera i s'inicia el moviment de la saba. Les rels tenen una gran concentració de sucres produïts durant l'estiu i emmagatzemats a les rels. En fondre's la neu l'aigua arriba en grans quantitats a les rels i entra dins d'elles, pels pèls absorbents, per efecte de la pressió osmòtica i fa que la saba pugi cap a les fulles. Però a la majoria de vegetals no és possible explicar l'ascensió de la saba per mitjà de la pressió osmòtica fins a les fulles. A les parts més altes dels vegetals, la saba ascendeix a causa del descens de pressió provocat per la transpiració de les fulles. També hi ha situacions, com als mangles, que passa al contrari, ja que les rels estan dins aigua salada, i es produeix una osmosi inversa.[17]
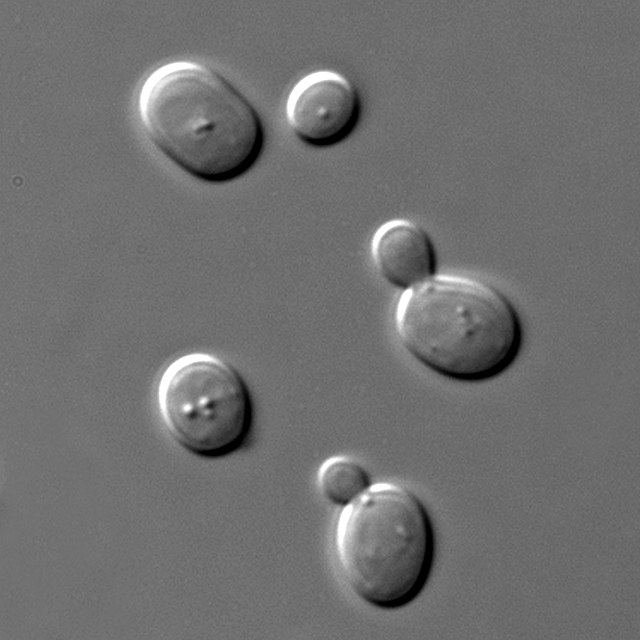
S'anomenen osmòfils els organismes extremòfils que poden créixer en ambients amb una alta concentració de sucre.[15] Els osmòfils són similars als organismes halòfils (amants de la sal). L'alta concentració de sucre representa un factor limitant del creixement de molts microorganismes, però els osmòfils aconsegueixen protegir-se contra aquesta alta pressió osmòtica mitjançant la síntesi d'osmoprotectors, com ara alcohols i aminoàcids. Gairebé tots els microorganismes osmòfils formen part dels gènere dels llevats. Són importants perquè causen el deteriorament de productes com els sucs de fruita, sucs de fruita concentrats, xarops, mel i, en alguns casos, massapà, però també tenen aplicacions industrials beneficioses com la fermentació alcohòlica de la cervesa. Alguns exemples d'osmòfils són: Saccharomyces rouxii, Saccharomyces bailii, Debaryomyces i Saccharomyces cerevisiae el llevat de la cervesa. Saccharomices deriva del grec, que significa "floridura del sucre".
Una de les aplicacions científiques de la pressió osmòtica és la determinació de masses moleculars, o masses molars, de macromolècules. A partir de l'equació de Van't Hoff es pot aïllar la massa molar, M, del solut dissolt:
Aïllant la massa molar queda en funció de variables que es poden mesurar al laboratori: la massa dissolta de solut, m, la constant dels gasos ideals, R, la temperatura absoluta, T, el volum de dissolució, V, i la pressió osmòtica, Π:
En diversos tipus de laboratoris es pot determinar la concentració total de partícules en dissolució osmòticament actives, coneguda com a osmolalitat o osmolaritat, mitjançant mesures de pressió osmòtica. Els aparells que s'utilitzen s'anomenen osmòmetres de membrana. Són aparells automatitzats que permeten la realització de les determinacions de pressió osmòtica de forma ràpida.

En la indústria s'empra la osmosi inversa. És un procediment que inverteix la difusió normal de dissolvent des de la dissolució diluïda cap a la dissolució concentrada aplicant una pressió sobre la dissolució concentrada que supera la pressió osmòtica i permet el pas de dissolvent des de la dissolució concentrada a la diluïda.
Els camps d'aplicació de l'osmosi inversa cada dia augmenten. Els diferents tipus de membranes semipermeables han servit pel tractament d'una infinitat de mescles, sigui per concentrar-les o diluir-les. Les àrees de l'enginyeria que més s'han vist afavorides amb aquestes aplicacions són principalment les indústries dels aliments, del paper, la biomedicina, la petroquímica, la nuclear i, entre d'altres, la de separació o purificació de gasos, on s'obté hidrogen de la dissociació de l'amoni, el sulfur d'hidrogen del gas natural de les refineries, heli del gas natural, així com l'enriquiment de l'oxigen a partir de l'aire. Hem de fer especial menció en les aplicacions de les membranes, la recuperació de substàncies valuoses en aigües o gasos de rebuigs industrials i que com a desaprofitament simplement són causa d'una severa contaminació ambiental. L'aplicació més emprada però és la dessalinització d'aigua de la mar per a la seva potabilització, cosa que ha permès abastir d'aigua de qualitat poblacions situades a llocs on els recursos hídrics són insuficients.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.