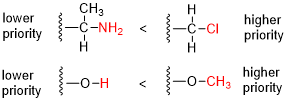Cahnova–Ingoldova–Prelogova pravidla
pravidla pro řazení substituentů při popisu organických stereoizomerů From Wikipedia, the free encyclopedia
Remove ads
Cahnova–Ingoldova–Prelogova pravidla (CIP pravidla) jsou způsobem jednoznačného určení názvů stereoizomerů dané molekuly.[1][2]
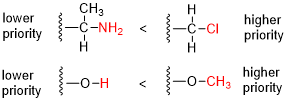
Účelem těchto pravidel je stanovení absolutní konfigurace podle symbolů R a S pro každé stereocentrum a E a Z pro každou dvojnou vazbu tak, aby bylo možné určit jednoznačně systematický název molekuly. Každé stereocentrum i dvojná vazba vytváří dvojici možných izomerů. Molekula s n stereocentry má obvykle 2n stereoizomerů a 2n−1 diastereomerů, kde je každému z nich přiřazena dvojice enantiomerů.[3]
Pomocí těchto pravidel lze přesně pojmenovat každý stereoizomer organické sloučeniny, kde mají všechny atomy vaznosti menší nebo rovny 4 (nebo rovny 6).[2]
Článek popisující tato pravidla vydali Robert Sidney Cahn, Christopher Kelk Ingold, a Vladimir Prelog v roce 1966, přičemž byla pravidla do přijetí Mezinárodní unií pro čistou a užitou chemii (IUPAC) v roce 1974 několikrát upravena.[4][2]
Ojediněle mohou mít dva různé stereoizomery stejné molekuly podle Cahnových–Ingoldových–Prelogových pravidel shodné označení a k pojmenování je pak třeba použít jiný systém.[5]
Remove ads
Postup
Určení konfigurací molekul podle CIP se skládá z těchto kroků:
- Nalezení stereocenter a dvojných vazeb;
- Určení priorit skupin navázaných na každé stereocentrum nebo atom vytvářející dvojnou vazbu
- Přiřazení R/S a E/Z konfigurace.
Určení priorit
Označení R/S a E/Z se přisuzují podle priorit skupin navázaných na každé stereocentrum. Postupy pro určení těchto priorit jsou základem Cahnových–Ingoldových–Prelogových pravidel. V následujícím přehledu nejsou uvedena některá pravidla, která se využívají jen zřídka.
- Porovnají se atomová čísla (Z) atomů přímo napojených na stereocentrum; skupina, jejíž atom má vyšší atomové číslo, získává vyšší prioritu.
- Pokud nelze rozhodnout podle prvního pravidla, uvažují se atomy vzdálené od stereocentra o dvě vazby: pro každý atom vázaný na ten, který je přímo spojen se stereocentrem, se číslování provede zvlášť, v pořadí podle klesajícího atomového čísla Z. Tyto seznamy se porovnají po jednotlivých atomech, skupina obsahující atom s vyšším Z získá vyšší prioritu.
- Jestliže stále nelze rozhodnout, tak se každý atom v těchto dvou seznamech nahradí „podseznamy“ odpovídající dalším na něj navázaným atomům (ve vzdálenosti 3 od stereocentra), podseznamy se uspořádají podle klesajících atomových čísel Z, a celá struktura se posuzuje po jednotlivých atomech. Tento postup se opakuje, dokud není rozhodnuto.
Izotopy
Pokud se dvě skupiny liší pouze izotopem daného prvku, pak má vyšší prioritu atom s větší relativní hmotností.[6]
Dvojné a trojné vazby

Pokud je atom, A, s jiným spojen dvojnou vazbou, pak se s ním zachází, jako by byl „navázán na stejný atom dvakrát“.[7] Atom s dvojnou vazbou získává vyšší prioritu než atom připojený vazbou jednoduchou.[7][8] Když se B nahradí seznamem na něj navázaných atomů, pak se samotný atom A při vytváření priorit neuvažuje.
S trojnými vazbami se zachází podobně, s tím rozdílem, že A a B jsou každý spojený s dvěma „fantomy“ druhého.[2]
Geometrické izomery
V případě, kdy jsou substituenty vzájemně geometrickými izomery, má Z-izomer přednost před E-izomerem; stereoizomer s dvěma skupinami vyšší priority na stejné straně dvojné vazby (cis) se označuje Z. a ten, který má takové skupiny na opačných stranách vazby C=C (trans) jako E.[9]
Cyklické molekuly
U molekul obsahujících jeden nebo více kruhů je nejprve potřeba přepsat vzorec do podoby stromu (označovaného jako hierarchický digraf) přechodem přes všechny možné cesty začínající ve stereocentru. Při přejití přes již projitý atom se vytvoří nepravý atom, který udržuje konečnost stromu. Různé atomy původní molekuly se mohou objevit na řadě míst stromu.[4]
Přidělení popisků
Stereocentra: R/S

Chirální sp3-hybridizovaný izomer má čtyři různé substituenty. Po přidělení priorit těmto substituentům se molekula natočí v prostoru takovým způsobem, že skupina s nejnižší prioritou směřuje od provozovatele. Jestliže se substituenty od nejvyšší priority po nejnižší očíslují 1 až 4, pak stereoizomerii příslušného centra určí smysl otáčení křivky procházející přes 1, 2, a 3. V případě konfigurační izomerie je skupina s nejnižší prioritou (nejčastěji vodík) za rovinu nebo na přímku směřující od pozorovatele. Na skupinu nejvyšší priority se načrtne křivka spojující ji s ostatními skupinami, přičemž končí na skupině třetí priority; pokud prochází ve směru hodinových ručiček, označí se izomer jako (R),v opačném případě jako (S) – podle latinských výrazů pro pravý a levý.[10][11]
Tato označení se umisťují do závorek před název sloučeniny; například 3-methylpent-1-en s konfigurací R bude mít název (R)-3-methylpent-1-en.[8]

Označení R/S lze rozlišit pomocí „pravidla pravé ruky“: prsty se ohnou ve směru 1 → 2 → 3 a jestliže palec ukazuje ve směru ke čtvrtému substituentu, pak jde o R enantiomer, v opačném případě o S.
Ojediněle se mohou dva substituenty na atomu lišit pouze svou absolutní konfigurací (R nebo S). Pokud je potřeba zjistit priority takovýchto substituentů, pak má R přednost před S a popisek stereocentra se označí malým písmenem (r nebo s) namísto velkého.[12]
Dvojné vazby a E/Z
Podrobnější informace naleznete v článku Značení E-Z.
Cahnova–Ingoldova–Prelogova pravidla určují také priority substituentů na dvojných vazbách. Pokud se obě skupiny s vyšší prioritou nachází na stejné straně od dvojné vazby (cis-konfigurace), pak se daný stereoizomer označí Z. Jestliže se takové skupiny nachází na opačných stranách (trans-konfigurace), pak se stereoizomer označí jako E-.[13]
Koordinační sloučeniny
VA některých případech je nutné určit konfiguraci vytvořených stereogenních center, která bez nekovalentních interakcí nejsou chirální. V těchto případech se použije pravidlo, že nekovalentním interakcím se přiřadí při určování priorit číslo mezi 0 a 1.[14]
Spirosloučeniny
Některé spirosloučeniny, například ligandy (R)- a (S)-7,7'-bis(difenylfosfanyl)-2,2',3,3'-tetrahydro-1,1'-spirobi[inden]) jsou chirální, přičemž kruhy jsou navzájem otočeny přibližně o pravé úhly a molekuly nejsou navzájem zrcadlovými obrazy.[8] Spirouhlík vytváří stereogenní centrum, přičemž priority jsou v pořadí a>a′>b>b′, kde jeden kruh má vedle uhlíkového spiroatomu a a b a druhý a′ a b′; konfiguraci tak zde lze stanovit stejně jako u jiných stereocenter.
Příklady
Níže jsou zobrazeny příklady využití Cahnových–Ingoldových–Prelogových pravidel.[15]
Remove ads
U molekul s více centry
Jestliže má molekula více stereocenter, pak se označení R nebo S přidělí každému zvlášť; například efedrin vytváří (1R,2S) a (1S,2R) stereoizomery, které jsou navzájem zrcadlovými obrazy, a jde tedy o enantiomery. Tato sloučenina vytváří také jinou dvojici enantiomerů, označovanou (1R,2R) a (1S,2S), se souhrnným názvem pseudoefedrin. Všechny tyto čtyři izomery odpovídají systematickému názvu 1-fenyl-2-(methylamino)propan-1-ol, efedrin a pseudoefedrin jsou ale diastereomery, nejde tedy o enantiomery, protože jejich molekuly nejsou navzájem zrcadlovými obrazy, z tohoto důvodu mají. i jako racemické směsi, odlišné chemické vlastnosti a jsou označovány různými názvy.
Pokud jsou dvě molekuly navzájem enantiomery, tak jsou jejich popisky opačné: (R,R) a (S,S) jsou dvojicí enantiomerů, podobně jako (R,S) a (S,R). Diastereomery mají nejméně jeden popisek společný; například (R,S) a (R,R) jsou diastereomery, podobně také (S,R) a (S,S). Stejné pravidlo platí i pro molekuly s více než dvěma stereocentry: pokud mají dva stereoizomery alespoň jeden popisek společný, jedná se o diastereomery a když jsou všechny odpovídající si popisky vůči sobě opačné, jde o enantiomery.
Mesosloučeniny nevykazují chiralitu, i když mají dvě nebo více stereocenter. Jejich molekuly jsou každá svým vlastním zrcadlovým obrazem, což snižuje celkový počet stereoizomerů oproti 2n. Takovéto molekuly mají roviny souměrnosti, což způsobuje rotaci kolem vazeb uhlík–uhlík.[8] Jako příklad lze uvést kyselinu mesovinnou, jejíž (R,S) izomer je stejný jako (S,R). U mesosloučenin vytváří R a S stereocentra navzájem souměrně umístěné dvojice.[16]
Remove ads
Relativní konfigurace
Relativní konfigurace dvou stereoizomerů lze popsat pomocí písmen R a S s hvězdičkou (*). (R*,R*)znamená, že obě centra mají stejnou konfiguraci, (R,R) či (S,S); (R*,S*) znamená, že jejich konfigurace jsou opačné, (R,S) nebo (S,R). Začíná se u centra, které má nejnižší číslo podle systematického názvosloví, které se označí jako R*.
K rozlišení dvojice anomerů se používají značky alfa (α) a beta (β). V případě α anomeru má anomerní atom uhlíku vůči referenčnímu atomu opačnou konfiguraci, (R,S) nebo (S,R), u β anomeru jsou shodné, (R,R) nebo (S,S).[17]
Strany

Stereochemie také určuje strany trigonálních molekul, jako jsou ketony. Nukleofil se při nukleofilní adici může ke karbonylové skupině přiblížit z jedné ze dvou stran. Při reakci acetonu s nechirálním nukleofilem jsou obě strany totožné a vzniká jediný produkt. U butanonu nejsou strany stejné (enantiotopní) a vzniká racemická směs produktů. Je-li použit chirální nukleofil, tvoří se diastereomery. V případech, kdy je přístup k jedné ze stran stíněn substituenty nebo sterickými efekty, pak jsou strany diastereotopní. Pravidlo, podle něhož se určuje stereochemie stereocentra (R nebo S), se také používá k označování stran funkčních skupin, tyto strany se poté označují Re- a Si-.[18]
Na příkladu vpravo je znázorněn acetofenon z Re-strany. Navázání hydridu z této strany vytvoří (S)-enantiomer a při přístupu z opačné strany (Si-) vznikne (R)-enantiomer; navázání skupiny na prochirální molekulu z Re-strany ale nevytvoří vždy (S)-stereocentrum, je totiž třeba brát v úvahu prioritu dané skupiny, absolutní stereochemii produktu tak je třeba určovat pokaždé zvlášť a ne podle strany, na které reakce probíhá. Ve výše uvedeném příkladu by navázání chloridu (Z = 17) na prochirální centrum z Re-strany vedlo k (R)-enantiomeru.
Remove ads
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads