Dusičnan amonný
amonná sůl kyseliny dusičné From Wikipedia, the free encyclopedia
Remove ads
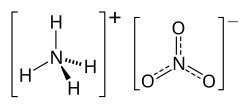
Dusičnan amonný, triviálním názvem ledek amonný či amoniumnitrát, je chemická sloučenina (dusičnan amoniaku) s chemickým vzorcem NH4NO3. Je to bílá krystalická látka používaná jako zemědělské hnojivo a díky oxidačním vlastnostem také v pyrotechnice.
Remove ads
Bezpečnost
Dusičnan amonný se při opatrném zahřátí bezvýbušně rozkládá na oxid dusný („rajský plyn“) a vodní páru:
- NH4NO3 → N2O + 2 H2O
Jinak se může také při zahřátí nebo jiné iniciaci rozložit prudkou exotermní reakcí
- NH4NO3 → N2 + 1/2 O2 + 2 H2O
s vývojem velkého objemu plynných produktů; tedy dojde k detonaci. Účinek se zesílí přidáním malého množství hořlaviny, odpovídajícího produkovanému kyslíku. Tak vzniká významná průmyslová trhavina, používaná i jako munice (letecké bomby).
Velké zásoby ledku amonného, který je jinak vynikajícím dusíkatým hnojivem, jsou významným požárním rizikem, podporují hoření a mohou snadno vést až právě k detonaci. Výbuchy dusičnanu amonného nejsou vzácným jevem, k méně závažným případům dochází téměř každoročně. Zaznamenáno však bylo i několik rozsáhlých, zničujících výbuchů, k nimž se řadí:
- Exploze 4500 t v Oppau (dnes součást města Ludwigshafen) v Německu 21. září 1921 (561 mrtvých)
- Neštěstí v Texas City (přístav v Mexickém zálivu) v USA 16. dubna 1947 (2300 t, 581 mrtvých)
- Exploze chemičky AZF v Toulouse, Francie 21. září 2001[2]
- Exploze v továrně Adair Grain, West (TX), USA, 17. dubna 2013[3]
- Exploze v Tchien-ťinu (přístav ve Žlutém moři) v Číně 12. srpna 2015
- Výbuch 2750 t v přístavním skladu v Bejrútu (Středozemní moře) v Libanonu 4. srpna 2020 [4] (přes 200 mrtvých, poškozeno obydlí 300 tis. obyvatel)
S ohledem na svou nebezpečnost je dusičnan amonný uveden v seznamu látek považovaných za prekurzory výbušnin, jejichž prodej nepodnikajícím fyzickým osobám podléhá v Evropské unii dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.[5] Dusičnan amonný nelze podle tohoto nařízení prodávat ani držet samostatně ani ve směsích či látkách, v nichž je koncentrace dusíku pocházejícího z dusičnanu amonného větší nebo rovna 16 % hmotnosti.
Remove ads
Příprava
Dusičnan amonný může vznikat přeměnou močoviny:
Průmyslově se však vyrábí reakcí kyseliny dusičné a čpavku:[6]
- HNO3 + NH3 → NH4NO3
Dusičnan amonný se také vyrábí amatérskými nadšenci reakcí:[7]
- Ca(NO3)2 + (NH4)2SO4 → 2 NH4NO3 + CaSO4
Tato reakce je silně exotermní. Lze ho také připravit reakcí AgNO3(aq) s NH4Cl(aq), přičemž vzniká jako nerozpustná sůl AgCl, která se dá odfiltrovat, takže výtěžek je pak poměrně vysoký.
Remove ads
Využití
- V zemědělství jako hnojivo (práškový[8] nebo ve směsi s močovinou jako vodný roztok, tzv. DAM [9])
- V pyrotechnice
- Složka explosivní náplně některých bomb, např. BLU-82
Reference
Literatura
Související články
Externí odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads