Methan
chemická sloučenina From Wikipedia, the free encyclopedia
Remove ads
Methan (mimo chemii dle PČP metan) neboli podle systematického názvosloví karban je chemická sloučenina uhlíku a vodíku s molekulárním vzorcem CH4 a je nejjednodušším zástupcem skupiny látek alkanů. Za normálních podmínek je to bezbarvý, bez zápachu a hořlavý plyn. Metan je ve vodě málo rozpustný a vytváří výbušné směsi se vzduchem. Hoří modro-jasným plamenem v přítomnosti dostatečného množství kyslíku na oxid uhličitý a vodu.

V přírodě se vyskytuje především jako hlavní složka zemního plynu. Protože se vyskytuje ve velkém množství v ložištích, je atraktivním zdrojem energie. Přeprava probíhá potrubím nebo jako hluboko zmrazená kapalina (LNG) tankery. Dále se vyskytuje jako methanový hydrát vázaný na mořské dno a v oblastech s věčným ledem, i když přesné množství není známo. Metan slouží jako topný plyn a má velký význam v chemickém průmyslu jako výchozí materiál pro technické syntézy, jako je výroba metanolu nebo výroba halogenovaných derivátů methanu. Dále se používá k výrobě vodíku ve velkém průmyslovém měřítku.
Plyn je produkován ve značném množství biotickými procesy, buď anaerobně mikroorganismy, nebo aerobně fytoplanktonem, rostlinami a houbami. Antropogenní nepřímé zdroje zahrnují pěstování rýže a chov ovcí a skotu. Abiotické zdroje jako lesní požáry nebo sopečné erupce také uvolňují methan.
Metan je nejhojnějším uhlovodíkem v atmosféře Země, jehož koncentrace kolísá mezi severní a jižní polokoulí i sezónně. Jako skleníkový plyn má methan vysoký potenciál globálního oteplování. Přispěl ke globálnímu oteplování v dějinách klimatu a ovlivňuje současné globální oteplování. V atmosféře Země se oxiduje na methanol, formaldehyd, kyselinu mravenčí a nakonec na oxid uhličitý, kde vzniká i voda. Metan je součástí atmosfér jiných planet a měsíců a byl detekován jak v kometách, tak v mezihvězdném prostředí.
Remove ads
Příprava
Hlavním zdrojem methanu je přírodní surovina zemní plyn. Přímá příprava sloučením uhlíku s vodíkem je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes sirouhlík
- C + 2 S → CS2,
který pak reakcí se sulfanem (sirovodíkem) a mědí dá methan
- CS2 + 2 H2S + 8 Cu → CH4 + 4 Cu2S.
Jinou možností je reakce karbidu hliníku s vodou
- Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3.
Laboratorně se dá připravit žíháním směsi octanu sodného s hydroxidem sodným (natronovým vápnem)
- CH3COONa + NaOH → CH4 + Na2CO3.
Remove ads
Vlastnosti
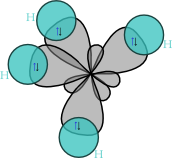
Molekula methanu má symetrii pravidelného čtyřstěnu (bodová grupa symetrie Td), v jehož těžišti se nachází uhlíkový atom a v jehož vrcholech se nacházejí vodíkové atomy. Díky této vysoké symetrii je celkově molekula methanu nepolární, přestože vazby H–C slabou polaritu vykazují.
Methan může reagovat explozivně s kyslíkem
CH4 + 2 O2 → CO2 + 2 H2O.
Bod samovznícení je sice velmi vysoký (595 °C, teplota vznícení při koncentraci 8,5 % je 537 °C), ale stačí např. elektrická jiskra nebo otevřený plamen a směs methanu se vzduchem může být přivedena k výbuchu (minimální iniciační energie je 0,28 mJ). Přitom meze výbušnosti jsou značně velké, od 4,4 do 15 objemových procent. Proto je nezbytně nutné průběžně sledovat koncentraci methanu (důlního plynu) v uhelných dolech, aby se předešlo katastrofám. Podobně prudce může methan reagovat i s plynným chlorem, je-li reakce iniciována prudkým zahřátím. Za normální teploty probíhá pomalu čtyřstupňově za vzniku chlorovaných derivátů methanu
- CH4 + Cl2 → CH3Cl + HCl,
- CH3Cl + Cl2 → CH2Cl2 + HCl,
- CH2Cl2 + Cl2 → CHCl3 + HCl,
- CHCl3 + Cl2 → CCl4 + HCl.
Podobně reaguje i s jinými halogeny. Jinak je málo reaktivní.
- Dokonalé hoření methanu
- CH4 + 2O2 → CO2 + 2H2O
- Nedokonalé hoření methanu
- CH4 + O2 → 2H2O + C, nebo
- 2CH4 + 3O2 → 4H2O + 2CO
Remove ads
Výskyt v přírodě
Methan se přirozeně vyskytuje na Zemi:
- v atmosféře, kam se dostává zejména jako produkt rozkladu látek biogenního původu (bioplyn), nebo jako produkt metabolismu velkých přežvýkavců, také z termitišť a z rýžových polí.
- v podzemí:
- jako hlavní složka zemního plynu
- jako součást důlního plynu v dolech
- rozpuštěný v ropě
- rozpuštěný ve vodě některých jezer, zvláště v Africe (např. jezero Kivu mezi Rwandou a Kongem)
- tvoří bublinky pod ledem rozmrzajícího permafrostu, například na Sibiři

Přítomnost ve vesmíru
Ve vesmíru byl nalezen v plynných mračnech v mezihvězdném prostoru.
Dále je obsažen v atmosférách velkých planet (Jupiter, Saturn, Uran a Neptun) sluneční soustavy. V pevném stavu je součástí tzv. ledových měsíců velkých planet a tvoří zřejmě nezanedbatelnou část hmoty transneptunických těles, případně je vysrážen ve formě ledu nebo jinovatky na jejich povrchu (např. Pluto). Byl také prokázán v komách komet.
Emise methanu
Podrobnější informace naleznete v článku Emise methanu.
Podle nejnovějších vědeckých hodnocení (IPCC, UNEP, IEA) se globální antropogenní emise methanu (cca 360 Mt CH₄ ročně) rozdělují mezi hlavní zdroje takto:
- Fosilní paliva (ropa, plyn, uhlí): ≈ 33 %
- Úniky při těžbě, přepravě a distribuci.
- Živočišná výroba (enterická fermentace, hnůj): ≈ 30 %
- Největší zdroj v zemědělství.
- Rostlinná výroba (pěstování rýže, biomasa): ≈ 18 %
- Odpady (skládky, čistírny odpadních vod): ≈ 15 %
- Ostatní zdroje: ≈ 4 %.
Přírodní zdroje (mokřady, geologické průsaky, požáry) tvoří asi 40 % globálních emisí, zatímco lidská činnost 60 %., roční globální emise methanu jsou odhadovány na cca 580 Mt CH₄.[2]
Použití

Hlavní oblastí použití methanu je energetika, kde slouží ve směsi s jinými uhlovodíky jako plynné palivo. V automobilové dopravě představuje jednu z pohonných látek, pod označením CNG (Compressed Natural Gas), stlačený zemní plyn, jehož hlavní složku tvoří právě methan.
Methan je spolu s kyslíkem používán jako palivo pro raketové motory vesmírné lodi Starship.[3]
V chemickém průmyslu se používá především k výrobě oxidu uhličitého dokonalým spalováním se vzduchem a při nedokonalém spalování k výrobě sazí používaných jako plnidlo a barvivo v gumárenském průmyslu. Pyrolýzou (tepelným rozkladem) za nepřístupu vzduchu se vyrábí ethyn (acetylen) a vodík.
Remove ads
Environmentální význam



Metan jako skleníkový plyn mohl přispět k největšímu masovému vymírání fanerozoika asi před 252 miliony let. Zvýšení jeho koncentrace v zemské atmosféře v moderní době je jedním z aspektů antropocénu.[4] Podle dvou studií Global Carbon Project pocházelo více než 60 % emisí methanu v roce 2017 z lidských aktivit.[5][6]
V roce 2021 dosáhla koncentrace v atmosféře 262 % úrovně před industrializací. Podle odhadů WMO vzrostla v roce 2021 globální průměrná koncentrace methanu o 18 na 1908 ppb. V roce 2020 se koncentrace zvýšila o 15 ppb, což je také více než dlouhodobý průměr.[7]
Atmosférická chemie
V okysličené atmosféře se methan pomalu oxiduje, zejména hydroxylovými radikály na oxid uhličitý a vodu. Tento proces je pomalý; poločas rozpadu se odhaduje na 12 let.[8][9]
V atmosféře Země methan nejprve reaguje s kyslíkem a vytváří formaldehyd a v případě potřeby ozon.[10] Další oxidace nakonec produkuje oxid uhličitý a vodu.
- CH4 + 4 O2 → HCHO + 2 O3 + H2O
- CH4 + O2 → HCHO + H2O
Ve stratosféře je methan hlavním zdrojem hydroxylových radikálů a vody, stejně jako přeměny atomového chloru na chlorovodík.[11]
- CH4 + O (1D) → CH3 + OH
- CH4 + Cl → CH3 + HCl
Potenciál globálního oteplování
Potenciál methanu pro globální oteplování, založený na období 100 let, je 28krát vyšší než potenciál stejného množství oxidu uhličitého podle hmotnosti. Podle nedávné studie je tento faktor 33, když se vezmou v úvahu interakce s atmosférickými aerosoly.[8][12] Během 20 let tento faktor stoupá na 84. Metan přispívá přibližně 20 až 30 % k antropogennímu skleníkovému efektu.[13] Podle Programu OSN pro životní prostředí (UNEP) by opatření proti emisím methanu mohla způsobit, že průměrná globální teplota vzroste do roku 2045 téměř o 0,3 °C pomaleji, než se očekávalo.[13] Ve srovnání s oxidem uhličitým má methan kratší dobu setrvání v zemské atmosféře (12 let oproti 5–200 letům).[14] V říjnu 2021 oznámil Program OSN pro životní prostředí (UNEP) založení Mezinárodní observatoře emisí methanu (IMEO), která má doplnit „Globální závazek k methanu“ zahájený USA a EU.[15][16] IMEO používá k identifikaci úniků methanu satelitní snímky.[17] Současně Světová meteorologická organizace (WMO) zaznamenala v roce 2021 nejvyšší nárůst koncentrace methanu v atmosféře od zahájení systematických měření. Nejrychlejší a nejefektivnější způsob, jak snížit emise methanu, by byl energetický sektor. Podle odhadů Mezinárodní energetické agentury (IEA) by bylo možné eliminovat 60 až 80 % těchto emisí bez dalších nákladů.[18]
Zdroje atmosférického methanu
Koncentrace methanu rostly přibližně o 0,5 ppb ročně mezi lety 2000 a 2006, od roku 2006 pak 5–10 krát více.[19] To znamená, že v atmosféře Země je mnohem více methanu než kdykoli za posledních 650 000 let.[20] Studie publikovaná v únoru 2020 výzkumníky z University of Rochester ukazuje silné důkazy, že z geologických zdrojů přirozeně uniká asi desetkrát méně methanu, než se dříve předpokládalo. Naopak těžba fosilních paliv (ropa, plyn a uhlí) představuje výrazně vyšší podíl emisí methanu.[21]
Každý rok se na Zemi vypustí asi 600 milionů tun methanu. V Česku roční emise methanu pohybují přibližně 300–350 tisíc tun (0,3–0,35 Mt CH4). Hlavními zdroji jsou zemědělství (především chov skotu) – okolo 50–55 % emisí, odpadové hospodářství (skládky, čistírny odpadních vod) – asi 20–25 %, energetika a fosilní infrastruktura (těžba ropy, plynárenská zařízení) – přibližně 20 %, ostatní zdroje – zbytek tvoří menší podíly z průmyslu a dalších činností. Pro srovnání: tyto emise odpovídají zhruba 8–9 milionům tun ekvivalentu CO2 (CO2e).[22]
Na začátku roku 2014, po metaanalýze více než 200 studií, vědecký časopis Science informoval, že Agentura pro ochranu životního prostředí USA (EPA) podhodnocovala emise metanu v USA po dobu 20 let.[23] V USA bylo ročně do atmosféry vypuštěno o 40 milionů tun více, než se dříve oficiálně předpokládalo, a to jak z přírodních zdrojů, tak z chovu dobytka například 88 milionů skotu v zemi, stejně jako z úniků v výrobních zařízeních a potrubích. Na základě údajů z terénních měření se roční emise methanu z dodavatelského řetězce ropy a plynu odhadují na přibližně 13 milionů tun ročně, což je o 60 % více než odhady americké Agentury pro ochranu životního prostředí. V případě těžby ropy a plynu jsou naměřené emise dvakrát vyšší než oficiální odhady. Pomocí Tropomiho spektrometru byly v roce 2018 naměřeny roční emise 2,9 ±0,5 milionu tun jen v Permské pánvi.[24] Není jasné (k roku 2014), do jaké míry mají chybná data vliv na výpočetní modely pro vývoj globálního klimatu.[25]
Frakování
Emise methanu se výrazně zvýšily, zejména ve Spojených státech. To by mohlo souviset s těžbou břidlicového plynu pomocí frakování (hydraulického štěpení).[26][27] Existují značné nejistoty ohledně rozsahu úniků methanu spojených s frakováním a důkazy, že tyto úniky mohou znevážit výhody spalování zemního plynu oproti jiným fosilním palivům. Podle studie publikované v roce 2020 vypouštějí frakovací závody dvakrát více methanu, než se dříve odhadovalo. Předpokládá se, že hydraulické štěpící závody v Pensylvánii mají míru úniku asi 10 %, což je považováno za reprezentativní pro průmysl hydraulického štěpení v USA obecně. Emise methanu v oblasti formace Marcellus byly stanoveny na přibližně 0,67 milionu tun ročně.[28]
Permafrost
Uvolňování methanu z věčně zmrzlé půdy a mořského dna je možným důsledkem a další příčinou globálního oteplování.[29] Metan se uvolňuje z arktických půd permafrostu jak geologického, tak biologického původu, biogenního přeměnou permafrostu na mokřady. Biogenní methan se uvolňuje v závislosti na povětrnostních podmínkách, jako je teplota a sluneční dopad, zatímco methan geologického původu se uvolňuje nezávisle.[30]
Těžba a přeprava ropy a uhlí
Neodhalené úniky v rafineriích a během přepravy ropy a plynu potrubím způsobují únik značného množství methanu do zemské atmosféry. Na konci roku 2017 odhadla Mezinárodní energetická agentura (IEA) v Paříži tuto hodnotu na přibližně 75 milionů tun ročně, což představuje 1,7 % celkové produkce.[31]
Studie naznačují, že emise methanu z uhelných dolů byly výrazně podceňovány.[32] Například v roce 2014 satelitní data zaznamenala obrovské emise methanu z blízkých uhelných dolů v oblasti kolem Four Corners. S odhadovanými 600 000 tunami methanu ročně jsou emise vyšší než v celém britském ropném, plynárenském a uhelném průmyslu.[33]
Pěstování rýže, chov koz, ovcí a skotu
Přibližně 70 % emisí methanu produkovaného mikroorganismy na Zemi je způsobeno lidskou činností. Emise methanu ze zemědělství a chovu zvířat přispívají k tomu asi z 40 až 46 %. Z toho asi 66 % tvoří chov dobytka, 20 % pěstování rýže a asi 7 % generuje chlévský hnůj.[34] Mnoho rostlin neustále produkuje methan, a proto vždy přispívalo k obsahu methanu v atmosféře.[35]
Archaeální producenti methanu v bachoru přežvýkavců jsou zodpovědní za neustálou tvorbu nového methanu. Domácí dobytek vypouští přibližně 150 až 250 litrů methanu denně, protože metanogeny se podílejí na rozkladu celulózy v žaludku skotu. Intenzivně se zkoumá snižování emisí methanu z krav pomocí přísad do krmiv.[36][37][38][39][40] Jedním z přísad do krmiva, které jsou nyní na trhu dostupné, je Bovaer.[41] Je možné, že emise methanu přežvýkavců lze snížit speciálními očkováními.[42] Tvorba methanu také snižuje energii, kterou zvířata poskytují příjemem potravy, a proto není dostupný pro produkci mléka, masa ani vlákniny. Ztráta energie byla odhadnuta na přibližně 6 až 10 % hrubé spotřeby energie.[43]
Remove ads
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





