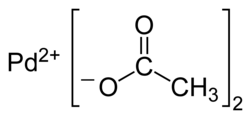
Octan palladnatý
chemická sloučenina From Wikipedia, the free encyclopedia
Remove ads
Octan palladnatý je palladnatá sůl kyseliny octové. Je považován za reaktivnější než odpovídající sloučenina platiny. Je rozpustný v mnoha organických rozpouštědlech a často se používá jako katalyzátor organických reakcí a jako prekurzor dalších palladnatých katalyzátorů.
Remove ads
Struktura
I když má tato sloučenina poměr atomů palladia a octanových ligandů 1:2, jak odpovídá jejich oxidačním číslům, skutečná molekulární struktura závisí na způsobu přípravy.
Tak jak byl připraven Wilkinsonem a pomocníky roku 1965 a v roce 1970 studován Skapským a Smartem pomocí jednokrystalové rentgenové difrakce, jde o hnědožlutou pevnou látku krystalizující v jednoklonných vrstvách. Bylo zjištěno, že jeho struktura je trimerní, složená z rovnostranných trojúhelníků, kde je každý atom Pd navázán na dvě acetátové skupiny. Každý atom kovu zaujímá přibližně čtvercovou rovinnou koordinaci.[2][3]
Octan palladnatý připravený lehce odlišným způsobem byl izolován jako světle růžový prášek, u něhož byla rentgenovou difrakcí zjištěna struktura v podobě dlouhých řetězců atomů palladia, z nichž je každý propojen se sousední dvojicí acetátových můstků, kde je koordinační geometrie kolem každého atomu palladia čistě čtvercově rovinná.[4]
Remove ads
Příprava
Octan palladnatý může být připraven v trimerní formě průtokem horké koncentrované kyseliny octové a kyseliny dusičné skrz houbovité palladium. Přebytečné množství houbovitého palladia nebo vyšší tok plynného dusíku zabraňuje kontaminaci produkty obsahujícími dusitanový ligand místo jednoho z acetátů (Pd3(OAc)5NO2).[5][6]
- Pd + 4 HNO3 → Pd(NO3)2 + 2 NO2 + 2 H2O
- Pd(NO3)2 + 2 CH3COOH → Pd(O2CCH3)2 + 2 HNO3
Tato nitrovarianta má odlišnou rozpustnost a jinou katalytickou aktivitu u mnoha reakcí. Zabránění nebo omezení její tvorby je důležité prospolehlivé používání octanu palladnatého.[7]
Podobně se připravuje propionát palladnatý; ostatní karboxyláty se získávají reakcí octanu palladnatého s odpovídající karboxylovou kyselinou.[2] Rovněž octan palladnatý je možné připravit reakcí jiného palladnatého karboxylátu s kyselinou octovou. Tato výměna ligandů začínající přečištěným karboxylátem je alternativním způsobem získávání octanu palladnatého bez kontaminatních nitrosloučenin.[7]
Remove ads
Reakce
Při zahřívání s alkoholy, nebo delším varu v jiných rozpouštědlech, se tato látka rozkládá na kyselinu octovou a kovové palladium.[2]
Použití
Katalýza
Octan palladnatý je katalyzátorem mnoha organických reakcí u řady druhů sloučenin, jako jsou alkeny, dieny a alkyl-, aryl- a vinylhalogenidy, při nichž se tvoří reaktivní addukty. Π-allyl koordinace a koordinace alkenů na octan palladnatý zahrnuje donaci typu sigma z π-orbitalu alkenu nebo π-allylu za současného zpětného π-navázání na prázdný π* orbital alkenu či π-allylu. Čím větší je sigma donace na kov, tím větší je zpětné navázání. Čím větší je zpětné navázání, tím větší je snížení řádu vazby.[8] Redukce alkenů nebo π-allylů octanem palladnatým obrací reaktivitu organického ligandu tím, že umožní spíše reakce s nukleofily než s elektrofily.[9]
Příklady reakcí katalyzovaných octanem palladnatým jsou:
- Vinylace, například Heckova reakce
- Přesmyk acyklických dienů, například Copeův přesmyk
- Karbonylační reakce jako je tvorba esterů z aryljodidů adicí oxidu uhelnatého a alkoholu nebo fenolu[10]
- Redukční aminace aldehydů nebo ketonů za použití mravenčanu draselného[11]
- Wackerův proces: oxidace ethenu ve vodě za vzniku acetaldehydu (prekurzoru polyvinylacetátu, běžné složky lepidel)
- Buchwaldova-Hartwigova aminace arylhalogenidů/pseudohalogenidů s alkyl- nebo arylaminy[12]
Tato látka převádí arylbromidy na aryltrimethylsilany, důležité funkční skupiny v řadě organických sloučenin jako je fungicid „Latitude“:
- RC6H4Br + Si2(CH3)6 → RC6H4Si(CH3)3 + Si(CH3)3Br
Octan palladnatý je kompatibilní s elektronovými vlastnostmi arylbromidů a tato metoda na rozdíl od mnoha jiných způsobů syntézy nevyžaduje vybavení pro vysoké tlaky.[13]
Prekurzor ostatních sloučenin palladia
Octan palladnatý se používá k tvorbě dalších palladnatých sloučenin; například fenylpalladiumacetát, používaný k izomerizaci allylalkoholů, se získává následující reakcí:
- Hg(C6H5)(CH3COO) + Pd(CH3COO)2 → Pd(C6H5)(O2CCH3) + Hg(O2CCH3)2
Octan palladnatý také reaguje s acetylacetonem (ligand „acac“) za vzniku acetylacetonátu palladnatého (Pd(acac)2), monomerní molekuly, která je prekurzorem kovového palladia.
Světlem či teplem se octan palladnatý redukuje za vzniku tenkých vrstev palladia a může vytvářet nanovlákna a koloidy.[5]
Remove ads
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads