Elektrogalvanisering
From Wikipedia, the free encyclopedia
Remove ads
Elektrogalvanisering er når et metal får overført metalioner fra et andet metal via en væske (elektrolyt) med samme metalioner som dem der skal overføres ved hjælp af elektrisk strøm. Dette fx for at beskytte metallet mod korrosion. Eksempelvis kobber der anvendes som anode (pluspol), mens det ønskede metal der skal galvaniseres er katoden (negative pol). Ved at sætte strøm til kredsløbet, vil anoden oxideres og frigive metalionerne via elektrolytten (sur/alkalisk) til katoden, som modtager metalionerne og kobberet deponeres herpå (reduceres).
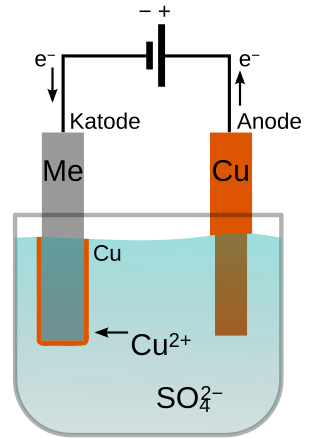
Eksemplet med kobber (Cu) som anode, zink (Zn) som katode i en opløsning af kobber(II)sulfat (CuSO4) i et jævnstrømssystem (DC)[1]:
Anoden (oxideres): Cu(s, højre) → Cu2+(aq) + 2e-(aq)
Katoden (reduceres): Cu2+(aq) + 2e-(aq) → Cu(s, venstre)
———————————————————————————
Samlet: Cu(s, højre) → Cu(s, venstre)
Remove ads
Referencer
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
