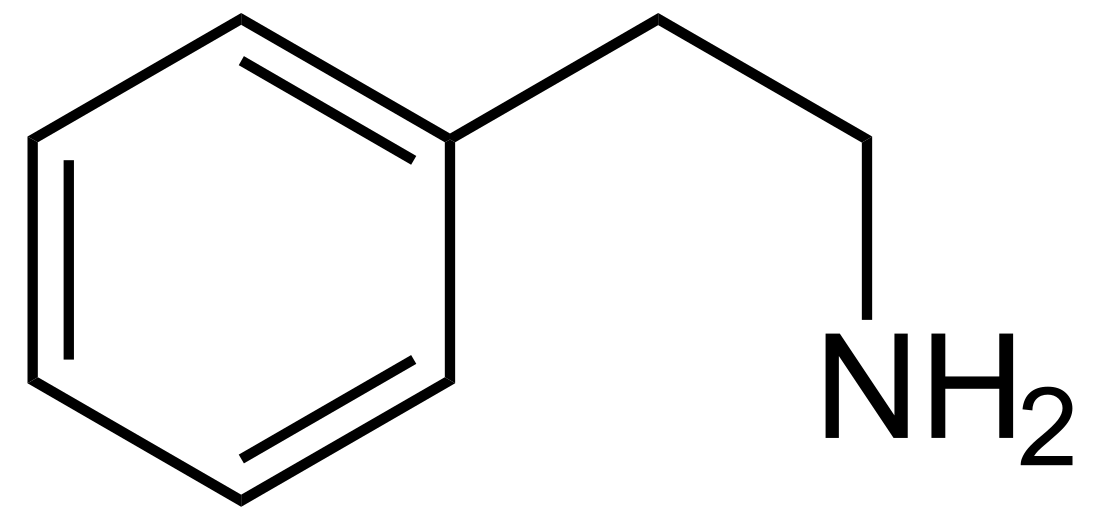
Phenethylamin (auch β-Phenylethylamin (PEA) oder mit korrekter chemischer Bezeichnung 2-Phenylethylamin) ist ein Spurenamin. Es ist die Stammsubstanz der Stoffgruppe der Phenylethylamine und als Vorläufer der Benzylisochinolin-Alkaloide in Pflanzen weit verbreitet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenethylamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H11N | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aminartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 121,18 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,96 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
200–202 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (4,3 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Brechungsindex |
1,5290 (25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten |
200 mg·kg−1 (LD50, Meerschweinchen, oral)[3] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen
Phenethylamin kommt im Bittermandelöl und in Kakaobohnen vor und wurde auch im Gehirn und im Harn nachgewiesen. Das biogene Amin Phenethylamin als Stammsubstanz der Katecholamine und vieler psychedelisch wirksamer Halluzinogene wird mit dem Entstehen von Lust- und Glücksempfindungen in Verbindung gebracht.[4]
Gewinnung und Darstellung
Phenethylamin ist eine natürliche Verbindung, die durch enzymatische Decarboxylierung aus der Aminosäure Phenylalanin biosynthetisiert wird.[4]
Technisch ist die Verbindung unter anderem durch katalytische Hydrierung von Benzylcyanid bei Temperaturen von 130 °C und Drücken von 140 bar an Raney-Nickel-Katalysatoren in flüssigem Ammoniak zugänglich.[5]

In einer weiteren möglichen Synthesevariante wird Benzaldehyd mit Nitromethan im Rahmen einer Henry-Reaktion zum Nitrostyrol kondensiert. Nach dessen Reduktion (Hydrierung) erhält man Phenethylamin.[4]
Chemie
Strukturbetrachtung
Homologe: Das nächsthöhere Seitenketten-Homologe ist das Amphetamin (-β-ethyl versus -isopropyl), weitere Homologe sind bekannt. Meskalin ist ein Beispiel für ein Phenylkern-Derivat (3,4,5-Trimethoxy-substituiert). Gleichzeitig Kern- und Seitenketten-substituiert ist beispielsweise das Noradrenalin. Zusammengefasst werden diese vielfältigen Strukturvarianten in der Stoffgruppe der Phenylethylamine dargestellt.
Wirkung
Oral aufgenommenes PEA hat bei Menschen erst in sehr hohen Dosen oder mit einem MAO-B-Inhibitor eine psychoaktive Wirkung. Sogar in Dosen von 1600 mg oral oder nasal und 50 mg intravenös zeigt sich kein Effekt.[6] Der Grund dafür mag darin liegen, dass PEA im menschlichen und tierischen Körper schnell abgebaut wird.[7] Die biologische Halbwertszeit bei oraler Aufnahme liegt bei fünf bis zehn Minuten.[8] Im Hirn hat Phenethylamin eine Halbwertszeit von etwa 30 Sekunden.[9] Im Menschen wird Phenethylamin durch die Phenylethanolamin-N-Methyltransferase (PNMT),[9][10] die Monoaminooxidase A (MAO-A),[11] die Monoaminooxidase B (MAO-B),[12] die Semicarbazid-sensitive Aminoxidasen (SSAOs),[13] die Flavin-enthaltende Monooxygenase 3 (FMO3),[14] und die Aralkylamin-N-acetyltransferase (AANAT, EC 2.3.1.87) verstoffwechselt.[15]
Patienten, die (zur Behandlung einer Depression oder eines Morbus Parkinson) einen Monoaminooxidase-Hemmer nehmen, sollten die Aufnahme von PEA meiden, da dies zu einem starken Blutdruckanstieg und Kopfschmerzen führen kann.[16]
Biologische Bedeutung
Einer Untersuchung des Departments of Cell Biology and Neurobiology an der Harvard Medical School[17] zufolge enthält der Urin einiger Raubsäuger erhöhte Mengen von Phenethylamin. Bestimmte Beutetiere (hier: Mäuse und Ratten) nehmen die Substanz olfaktorisch wahr und meiden mit Raubsäugerurin kontaminierte Bereiche.
Einzelnachweise
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.