Ομόλογη σειρά
From Wikipedia, the free encyclopedia
Remove ads
Ομόλογη σειρά ονομάζεται ένα σύνολο οργανικών ενώσεων (που λέγονται ομόλογες ενώσεις) στο οποίο τα διαδοχικά μέλη :
- Παριστάνονται με τον ίδιο γενικό μοριακό τύπο (ΓΜΤ).
- Κάθε μέλος διαφέρει από το αμέσως προηγούμενο ή από το αμέσως επόμενο κατά την ομάδα μεθυλένιο, -CH2-.
- Όλα τα μέλη έχουν ανάλογη σύνταξη (ίδιο τρόπο σύνδεσης των ατόμων και τους ίδιους δεσμούς) και περιέχουν την ίδια χαρακτηριστική ομάδα με αποτέλεσμα να έχουν όμοιες χημικές ιδιότητες και κοινές μεθόδους παρασκευής.
Παραδείγματα :
- Στην ομόλογη σειρά των κορεσμένων υδρογονανθράκων τα μέλη είναι : CH4, C2H6, C3H8, C4H10,... και ο ΓΜΤ : CnH2n+2 (n≥1).
- Στην ομόλογη σειρά των κορεσμένων μονοκαρβονικών οξέων τα μέλη είναι : HCOOH, CH3COOH, C2H5COOH, C3H7COOH, ... και ο ΓΜΤ : CnH2n+1COOH (n≥0).
Οι φυσικές ιδιότητες των ομόλογων ενώσεων (όπως πυκνότητα, σημείο βρασμού κλπ.) παρουσιάζουν συνήθως κανονική μεταβολή, που ακολουθεί την αύξηση της σχετικής μοριακής μάζας (Mr). Επειδή όμως οι φυσικές ιδιότητες επηρεάζονται και από τη σύνταξη των διαδοχικών ενώσεων, η κανονικότητα της μεταβολής τους εμφανίζεται στα διαδοχικά μέλη που έχουν ευθεία C-αλυσίδα. Στα πρώτα μέλη της σειράς που έχουν μικρή Mr η διαφορά στις φυσικές ιδιότητες είναι πολύ φανερή γι'αυτό το 1ο μέλος σε πολλές ομόλογες σειρές διαφέρει αισθητά από τα υπόλοιπα μέλη.
Γενικά οι φυσικοχημικές ιδιότητες των ομόλογων ενώσεων επηρεάζονται ακόμα και από τη μορφή της ανθρακικής αλυσίδας καθώς και από τη θέση της χαρακτηριστικής ομάδας.
Οι ομόλογες σειρές είναι πάρα πολλές στην οργανική χημεία[1] και αποτελούν υποκατηγορία των χημικών τάξεων κυρίως για λόγους ευκολίας στη μελέτη. Οι παρακάτω πίνακες περιέχουν μόνο τις ομόλογες σειρές που παρουσιάζουν πρακτικό και θεωρητικό ενδιαφέρον.
Remove ads
Ομόλογες σειρές άκυκλων υδρογονανθράκων
Οι ενώσεις του πίνακα αυτού περιέχουν μόνο C και Η και μπορεί να είναι κορεσμένες ή ακόρεστες.
Remove ads
Ομόλογες σειρές κορεσμένων ενώσεων με μια χαρακτηριστική ομάδα
Ομόλογες σειρές ενώσεων που περιέχουν οξυγόνο (Ο)
Οι ενώσεις αυτού του πίνακα περιέχουν δεσμό C-Ο ή C=O, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες.
Ομόλογες σειρές ενώσεων που περιέχουν αλογόνο (Χ)
Οι ενώσεις αυτού του πίνακα περιέχουν δεσμό C-Χ, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες. Μπορεί να περιέχουν και δεσμό C=O.
Ομόλογες σειρές ενώσεων που περιέχουν άζωτο (Ν)
Οι ενώσεις αυτού του πίνακα περιέχουν δεσμούς C-Ν ή C≡N, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες. Μπορεί να περιέχουν και δεσμoύς C-O-Ν ή C=O.
Ομόλογες σειρές ενώσεων που περιέχουν θείο (S)
Οι ενώσεις αυτού του πίνακα περιέχουν δεσμούς C-S, έχουν μόνο μια χαρακτηριστική ομάδα και είναι κορεσμένες. Στην περίπτωση των όξινων θειικών εστέρων περιέχουν δεσμό C-O-S .
Remove ads
Ομόλογες σειρές καρβοξυλικών οξέων
Οι οργανικές ενώσεις των ομόλογων σειρών που περιγράφονται παρακάτω έχουν μία ή περισσότερες καρβοξυλομάδες (-COOH), είναι κορεσμένες (με εξαίρεση την ομόλογη σειρά των ακόρεστων μονοκαρβοξυλικών οξέων) και ίσως περιέχουν και μία ή περισσότερες χαρακτηριστικές ομάδες διαφορετικού είδους (-OH και -NH2). Ενδιαφέρον παρουσιάζουν διάφορα μέλη όπως το ακρυλικό οξύ, το μεθακρυλικό οξύ, το ελαϊκό οξύ, διάφορα δικαρβοξυλικά οξέα όπως το οξαλικό, το μηλονικό κ.ά. Επίσης κάποια υδροξυ-οξέα όπως το γαλακτικό οξύ και το τρυγικό οξύ. Τέλος τεράστιο ενδιαφέρον για τη βιολογία-βιοχημεία έχουν τα αμινοξέα που ανήκουν στα αμινο-καρβοξυλικά οξέα.
Remove ads
Ομόλογες σειρές κυκλικών μη αρωματικών υδρογονανθράκων
Οι κυκλικές ενώσεις του πίνακα αυτού περιέχουν μόνο C και Η και μπορεί να είναι κορεσμένες ή ακόρεστες.
Remove ads
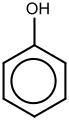
Ομόλογες σειρές αρωματικών ενώσεων
Αρωματική θεωρείται μία ένωση που στο μόριο της περιέχει έναν τουλάχιστον βενζολικό δακτύλιο (1,3,5-κυκλοεξατριένιο). Ωστόσο είναι σημαντικό να αναφέρουε ότι για να είναι κυριολεκτικά αρωματική μία ένωση δεν είναι απαραίτητο να περιέχει βενζολικό δακτύλιο. Οι αρωματικές ενώσεις έχουν τελείως διαφορετική χημική συμπεριφορά από τις υπόλοιπες η οποία έχει να κάνει κυρίως με το γεγονός ότι ο κανόνας διπλός δεσμός-απλός δεσμός ισχύει προσεγγιστικά, μιας και οι απλοί δεσμοί μιας α χρονικής στιγμής γίνονται διπλοί σε μία β χρονική στιγμή. Έτσι όλοι οι δεσμοί του βενζολίου στην πραγματικότητα είναι ημίδιπλοι. Ο προσδιορισμός επίσης ενός γενικού μοριακού τύπου είναι αρκετά περίπλοκος στις αρωματικές ενώσεις μιας και σε ενώσεις όπως οι αιθέρες, οι κετόνες, οι εστέρες και πολλές άλλες συχνά συναντώνται περισσότεροι του ενός βενζολικοί δακτύλιοι.Ωστόσο για να μπορέσουμε να ρίξουμε λίγο φως σ' αυτή τη μεγάλη κατηγορία ενώσεων παρουσιάζονται παρακάτω μερικές χαρακτηριστικές ομόλογες σειρές οι οποίες περιέχουν ένα μόνο βενζολικό δακτύλιο (με εξαίρεση τα ομόλογα ναφθαλινίου και ανθρακενίου και τις δευτεροταγείς και τριτοταγείς αρωματικές αμίνες), μία μόνο χαρακτηριστική ομάδα και διαφέρουν μεταξύ τους κατά ένα αλκύλιο (CnH2n+1).
Remove ads
Σημειώσεις
Πηγές
Δείτε επίσης
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads