Top Qs
Línea de tiempo
Chat
Contexto
Galactoquinasa
De Wikipedia, la enciclopedia libre
Remove ads
La galactocinasa (EC 2.7.1.6) es una enzima fosfotransferasa que cataliza la fosforilación de la D-galactosa a D-galactosa-1-fosfato utilizando ATP como donante del grupo fosfato.[3]
- D-galactosa + ATP α-D-galactosa-1-fosfato + ADP
La galactocinasa cataliza la primera etapa de la ruta de Leloir, una ruta metabólica encontrada en muchos organismos para el catabolismo de la β-D-galactosa a glucosa-1-fosfato.[4] La galactocinasa que fue aislada por primera vez del hígado de mamíferos, ha sido estudiada extensivamente en las levaduras,[5][6] arqueas,[7] plantas[8][9] y humanos.[10][11]
Remove ads
Isozimas
En el ser humano existen dos genes que codifican galactocinasas.
- El gen GALK1 codifica la galactocinasa 1.
- El gen GALK2 codifica la N-acetilgalactosamina cinasa. Esta enzima actúa como una galactocinasa cuando la galactosa está presente en altas concentraciones. De hecho se la conoce también como galactocinasa 2.[12]
Estructura
Resumir
Contexto

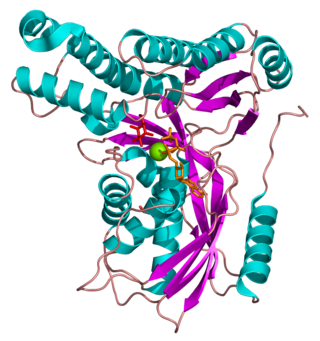
La galactocinasa está compuesta por dos dominios separados por un gran hueco. Las dos regiones son conocidas como los dominios N- y C-terminal. El anillo adenina del ATP se une en un agujero hidrofóbico localizado en la interfaz entre los dos dominios. El dominio N-terminal está compuesto por 5 filamentos formados de láminas beta y 5 hélices alfa. El dominio C-terminal está caracterizado por dos capas de láminas beta antiparalelas y 6 hélices alfa.[10] La galactocinasa no pertenece a la familia de las cinasas que actúan sobre carbohidratos, pero sí a la superfamilia de enzimas dependientes del ATP conocida como superfamilia GHMP cinasas.[14] GHMP es una abreviatura referente a los miembros originales de la familia: galactocinasa, homoserina cinasa, mevalonato cinasa y fosfomevalonato cinasa. Los miembros pertenecientes a la superfamilia GHMP tienen una gran similitud en su estructura tridimensional aunque solamente comparten entre un 10% y un 20% de su secuencia. Estas enzimas contienen tres motivos bien conservados (I, II y III), el segundo participa en la unión del nucleótido y tiene la secuencia Pro-X-X-X-Gly-Leu-X-Ser-Ser-Ala.[13]
Remove ads
Especificidad
En diferentes especies, las galactocinasas presentan una gran variedad de especificidad de sustrato.
- La galactocinasa de la Escherichia coli puede fosforilar 2-deoxi-D-galactosa, 2-amino-deoxi-D-galactosa, 3-deoxi-D-galactosa y fucosa. La enzima no puede tolerar ninguna modificación en el carbono 4 (C-4) de la galactosa, pero los cambios en el C-2 no interfieren con la función de la enzima.[15]
- Las galactocinasas de los humanos y ratas también son capaces de fosforilar la 2-deoxi-D-galactosa.[16][17]
- Contrariamente la galactocinasa de la Saccharomyces cerevisiae es altamente específica por la D-galactosa y no puede fosforilar glucosa, manosa, arabinosa, fucosa, lactosa, galactitol o 2-deoxi-D-galactosa.[5][6]
Por otra parte, las propiedades cinéticas de la galactocinasa también difieren en las diferentes especies.[10]
Mecanismo
Recientemente se han aclarado los roles de los aminoácidos del sitio activo de la galactocinasa humana. El Asp-186 extrae un protón del C1-OH de la α-D-galactosa y el alcóxido nucleófilo resultante ataca el γ-fosfato del ATP. Un grupo fosfato es transferido al azúcar y el Asp-186 es deprotonado por agua. El residuo cercano Arg-37 estabiliza a Asp-186 en su forma aniónica y se ha probado que es esencial para la función de la galactocinasa mediante experimentos de mutaciones puntuales.[11] Los residuos Asp y Arg del sitio activo están altamente conservado en las galactocinasas.[10]

Remove ads
Función biológica
La ruta de Leloir cataliza la conversión de galactosa en glucosa. La galactosa se encuentra en los productos lácteos, frutas y vegetales, y puede ser producida de forma endógena por la rotura de las glicoproteínas y glicolípidos. En la ruta de Leloir participan tres enzimas: galactocinasa, galactosa-1-fosfato uridiltransferasa y UDP-galactosa 4-epimerasa. La galactocinasa cataliza la primera etapa del metabolismo de la galactosa formando galactosa-1-fosfato.[4][18]

Remove ads
Relevancia clínica
La galactosemia es un desorden metabólico raro caracterizado por la capacidad reducida de metabolizar galactosa y puede ser producido por una mutación en cualquiera de las tres enzimas de la ruta de Leloir.[4] La deficiencia en galactocinasa, también conocida como galactosemia tipo II, es un desorden metabólico recesivo causado por una mutación en la galactocinasa humana. Alrededor de unas 20 mutaciones que causan galactosemia tipo II han sido identificadas. El principal síntoma es la aparición de cataratas a una edad temprana. En las células del cristalino del ojo humano, la aldehído reductasa convierte galactosa a galactitol. Como la galactosa no es catabolizada a glucosa debido a una mutación en la galactocinasa, el galactitol se acumula. El gradiente de galactitol a través de la membrana de las células del cristalino provoca que entre agua en las células provocando que se hinchen y una eventual apoptosis de las células.[19] El tratamiento más efectivo para la galactosemia es eliminar la lactosa de la dieta.
Remove ads
Enlaces externos
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads