Top Qs
Línea de tiempo
Chat
Contexto
Plata (I)
estado de oxidación más frecuente en el que se encuentra la plata De Wikipedia, la enciclopedia libre
Remove ads
La plata (I) es el estado de oxidación más frecuente en el que se encuentra la plata en los compuestos químicos. En soluciones ácidas o neutras es posible encontrar el catión Ag+; el cual, debido a la estabilidad de su configuración electrónica ([ Kr ] 4d10) que impide transiciones electrónicas en longitudes de onda del espectro visible, es incoloro.[1]
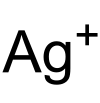
Comportamiento ácido-base
El catión Ag+ es poco ácido encontrándose solvatado en solución acuosa aún en pH débilmente alcalino (pH≈7,5). A pH mayores precipita el hidróxido de plata (AgOH), el cual se transforma espontáneamente en óxido de plata (Ag2O) más estable e insoluble.[1]
El óxido de plata no es apreciablemente soluble al aumentar el pH de la solución, si bien en soluciones altamente alcalinas parte del precipitado se disuelve por formación del anión argentito (AgO-).[1]
Remove ads
Reacciones
Resumir
Contexto
Reducción
El catión Ag+ es reducido fácilmente a Ag0 por reductores como el sulfato ferroso (en medio neutro a ebullición) o el catión manganeso (II) en medio alcalino.[1]
- 2 Ag+ + Mn2+ + 4 OH-
 2 Ag0 + MnO2 + 2 H2O
2 Ag0 + MnO2 + 2 H2O
- 2 Ag+ + Mn2+ + 4 OH-
Reacciones de precipitación
El catión Ag+ forma compuestos estables con un gran número de aniones. Algunos de ellos son coloreados y poseen propiedades que facilitan su identificación.
Reacciones de formación de complejos
Amoníaco
En medio amonical se forma el catión complejo diaminoplata(I).
log β1 = 3,31; log β2 = 7,23[3]
La formación del complejo solubiliza el cloruro de plata.[4]
Cianuro de plata
En exceso de reactivo el cianuro de plata se disuelve formando el anión complejo altamente estable dicianoargentato(I).[5][1]
log β2 = 20,5[2]
Reactivos orgánicos especiales
Son utilizados para la identificación de plata(I) en muestras complejas. Su utilización requiere, frecuentemente, un tratamiento previo y cumplimiento de un protocolo experimental en forma rigurosa, de modo tal de evitar interferencias provenientes de otros cationes que pudieran existir en la muestra.
Rodanina (p-dimetil-amino-benciliden-rodanina)
El catión Ag+ reacciona con la rodanina, en medio débilmente ácido, produciendo un quelato color rojizo-violáceo. Esta reacción es utilizada para identificar pequeñas cantidades del catión en una muestra. La interferencia de cationes Hg, Cu, Pb, Au, Pt, Pd y Ni puede ser reducida por el tratamiento previo de la muestra con cianuro de potasio (KCN).[1]
1,10-fenantrolina
El catión plata (I) forma con la 1,10-fenantrolina dos complejos diferentes dependiendo de su concentración en el medio.
log β1 = 5,02*; log β2 = 12,07*[3]
Remove ads
Condiciones físico-químicas de las constantes
- Si no se indica lo contrario, se considera 25 °C y medios con fuerza iónica nula (μ = 0).
- (*) Temperatura 25 °C y μ = 0,1.
Véase también
Referencias
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads