L'oxyde de cobalt(II), ou monoxyde de cobalt, est un composé chimique de formule CoO. Il s'agit d'un solide se présentant sous forme de cristaux rouges à vert-olive ou de poudre grise à noire. Il possède une bande interdite d'environ 2,4 eV. Il est très utilisé comme additif dans l'industrie de la céramique pour produire des émaux et des glaçures bleus ainsi que dans l'industrie chimique pour produire des sels de cobalt (II).
Faits en bref Identification, Nom UICPA ...
| Oxyde de cobalt(II) |
|
|

__ Co2+ __ O2−
|
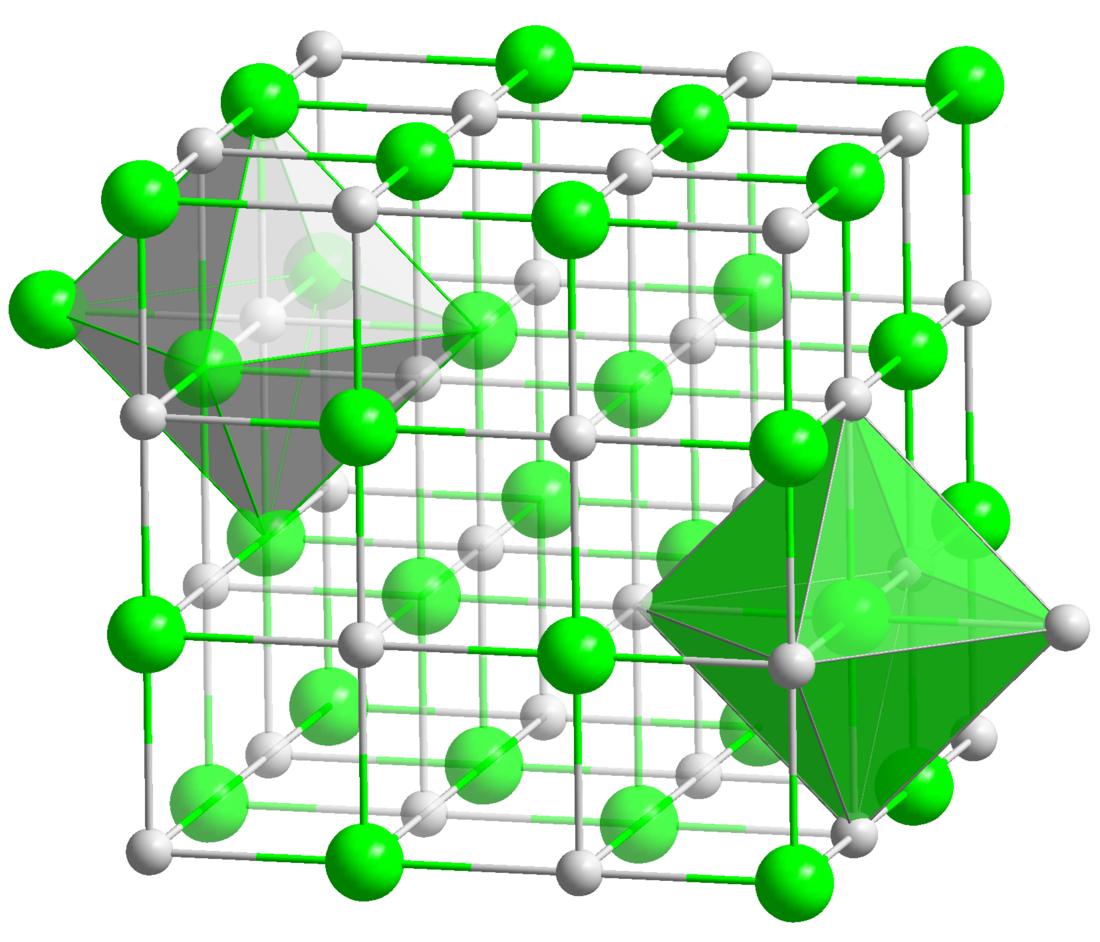
| Maille cristalline de l'oxyde de cobalt(II) |
| Identification |
| Nom UICPA
|
oxocobalt
|
| Synonymes
|
monoxyde de cobalt,
oxyde de cobalt,
noir de cobalt
|
| No CAS
|
1307-96-6
|
| No ECHA
|
100.013.777 |
| No CE
|
215-154-6
|
| PubChem
|
14786
|
| SMILES
|
|
| InChI
|
Std. InChI : vue 3D InChI =1S/Co.O Std. InChIKey : IVMYJDGYRUAWML-UHFFFAOYSA-N |
| Apparence
|
cristaux rouge à vert-olive, poudre grise à noire
|
| Propriétés chimiques |
| Formule
|
CoO [Isomères]
|
| Masse molaire[1]
|
74,932 6 ± 0,000 3 g/mol
Co 78,65 %, O 21,35 %,
|
| Propriétés physiques |
| T° fusion
|
1 935 °C[2]
|
| Solubilité
|
3,13 mg·l-1[2]
|
| Masse volumique
|
5,7 à 6,7 g/cm3[2] selon la préparation
|
| Cristallographie |
| Système cristallin
|
Cubique
|
| Classe cristalline ou groupe d’espace
|
(no 225)cubique
Hermann-Mauguin : 
Hermann-Mauguin court : 
Schoenflies :  |
| Structure type
|
Halite
|
| Précautions |
| SGH[2],[3] |
H301, H317, H330, H334, H410, P273, P280 et P501H301 : Toxique en cas d'ingestion
H317 : Peut provoquer une allergie cutanée
H330 : Mortel par inhalation
H334 : Peut provoquer des symptômes allergiques ou d'asthme ou des difficultés respiratoires par inhalation
H410 : Très toxique pour les organismes aquatiques, entraîne des effets à long terme
P273 : Éviter le rejet dans l’environnement.
P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage.
P501 : Éliminer le contenu/récipient dans …
|
| Transport[2] |
Code Kemler :68 : matière toxique et corrosive Numéro ONU :3288 : SOLIDE INORGANIQUE TOXIQUE, N.S.A. Classe :6.1 Étiquette : 6.1 6.1 : Matières toxiques Emballage :Groupe d'emballage I : matières très dangereuses ; |
| Composés apparentés |
| Autres cations
|
Oxyde de fer(II)
Oxyde de nickel(II)
|
| Autres anions
|
Sulfure de cobalt(II)
Hydroxyde de cobalt(II)
|
| Autres composés
|
Oxyde de cobalt(II,III)
Oxyde de cobalt(III)
|
|
| Unités du SI et CNTP, sauf indication contraire. |
| modifier |
Fermer
L'oxyde de cobalt(II) adopte la maille cristalline du sel gemme, avec un paramètre cristallin de 426,15 pm[4]. Il est antiferromagnétique en dessous de 16 °C[5].
L'oxyde de cobalt(II,III) Co3O4 se décompose en oxyde de cobalt(II) à 950 °C :
- 2 Co3O4 → 6 CoO + O2.
L'oxyde de cobalt(II) est disponible dans le commerce mais peut également être préparé en laboratoire par électrolyse d'une solution de chlorure de cobalt(II) CoCl2 :
- CoCl2 + H2O → CoO + H2 + Cl2.
Il peut également être préparé par précipitation de l'hydroxyde, suivie d'une décomposition thermique :
- CoX + 2 NaOH → Co(OH)2 + Na2X,
- Co(OH)2 → H2O + CoO.
Comme on peut s'y attendre, l'oxyde de cobalt(II) réagit avec les acides minéraux pour former les sels correspondants du cobalt :
- CoO + 2 HX → CoX2 + H2O.
L'oxyde de cobalt(II) est utilisé depuis des siècles pour colorer la céramique cuite au four. Il procure une coloration bleue profonde appelée bleu de cobalt ou smalt.