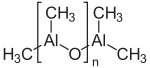
Le méthylaluminoxane, souvent appelé MAO, est un mélange de composés organoaluminiques de formule chimique approximative (Al(CH3)O)n[3]. Il est généralement distribué en solution dans des solvants aromatiques, souvent le toluène mais aussi le xylène, le cumène ou le mésitylène. Utilisé en fort excès, il active des précatalyseurs pour la polymérisation des alcènes[4],[5]. Il peut être obtenu par hydrolyse incomplète du triméthylaluminium Al2(CH3)6, comme indiqué par l'équation idéalisée[6] :
- n/2 Al2(CH3)6 + n H2O ⟶ (Al(CH3)O)n + 2n CH4.
Faits en bref Identification, Nom UICPA ...
| Méthylaluminoxane |
|
| Structure du méthylaluminoxane |
| Identification |
| Nom UICPA
|
méthyl(oxo)alumane
|
| No CAS
|
120144-90-3
|
| No ECHA
|
100.105.493 |
| No CE
|
485-360-0
|
| SMILES
|
|
| InChI
|
Std. InChI : vue 3D InChI =1S/CH3.Al.O/h1H3;; Std. InChIKey : CPOFMOWDMVWCLF-UHFFFAOYSA-N |
| Apparence
|
liquide incolore transparent[1]
|
| Propriétés chimiques |
| Formule
|
CH3AlO
|
| Masse molaire[2]
|
58,015 5 ± 0,001 3 g/mol
C 20,7 %, H 5,21 %, Al 46,51 %, O 27,58 %,
|
| Propriétés physiques |
| T° ébullition
|
111 °C[1]
|
| Masse volumique
|
0,895 g/cm3[1] à 25 °C
|
| Point d’éclair
|
4 °C[1]
|
| Limites d’explosivité dans l’air
|
1,2 % à 7 % en volume[1]
|
| Pression de vapeur saturante
|
28 hPa[1] à 20 °C
|
| Précautions |
| SGH[1] |
H225, H250, H260, H304, H314, H336, H361, H373, H403, H412, P201, P202, P210, P222 et P223H225 : Liquide et vapeurs très inflammables
H250 : S'enflamme spontanément au contact de l'air
H260 : Dégage, au contact de l'eau, des gaz inflammables qui peuvent s'enflammer spontanément
H304 : Peut être mortel en cas d'ingestion et de pénétration dans les voies respiratoires
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H336 : Peut provoquer somnolence ou vertiges
H361 : Susceptible de nuire à la fertilité ou au fœtus (indiquer l'effet s'il est connu)(indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger)
H373 : Risque présumé d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger)
H403 : Nocif pour les organismes aquatiques
H412 : Nocif pour les organismes aquatiques, entraîne des effets à long terme
P201 : Se procurer les instructions avant utilisation.
P202 : Ne pas manipuler avant d’avoir lu et compris toutes les précautions de sécurité.
P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer.
P222 : Ne pas laisser au contact de l’air.
P223 : Éviter tout contact avec l’eau, à cause du risque de réaction violente et d’inflammation spontanée.
|
| Transport[1] |
Numéro ONU :3394 : MATIÈRE ORGANO-MÉTALLIQUE LIQUIDE PYROPHORIQUE, HYDRORÉACTIVE Étiquettes : 4.2 4.2 : Matières sujettes à l'inflammation spontanée  4.3 4.3 : Matières qui, au contact de l'eau, dégagent des gaz inflammables Emballage :Groupe d'emballage I : matières très dangereuses ; |
|
| Unités du SI et CNTP, sauf indication contraire. |
| modifier |
Fermer
Divers mécanismes ont été proposés pour la formation du MAO[7]. Il existe par ailleurs des analogues bien définis de ce composé avec des substituants tert-butyle[8],[9].
Le MAO est bien connu pour être un activateur de catalyseurs de polymérisation d'alcènes par catalyse homogène. En catalyse de Ziegler-Natta classique, du chlorure de titane(III) TiCl3 activé au triméthylaluminium Al2(CH3)6. Ce dernier n'active que faiblement les précatalyseurs homogènes comme le dichlorure de zirconocène (η5-C5H5)2ZrCl2, mais Walter Kaminsky et al. ont découvert dans le milieu des années 1970 que les dichlorures de métallocènes du groupe 4 sont en revanche très fortement activés par le MAO, en donnant les catalyseurs de Kaminsky[10]. Cet effet a été découvert en versant un petite quantité d'eau sur un système catalytique Ziegler-Natta, qui s'en est trouvé activé.
Le MAO intervient de plusieurs manières dans le processus d'activation. Il intervient dans l'alkylation du chlorure de métal précatalyseur en donnant des intermédiaires méthyle de titane ou de zirconium. Il intervient également en retirant un ligand du précatalyseur méthylé pour donner un catalyseur insaturé électrophile. Ce catalyseur activé est une paire d'ions formée du catalyseur cationique et d'un dérivé anionique du MAO faiblement basique[11]. Le MAO permet également d'éliminer les impuretés protiques.








