Top Qs
Chronologie
Chat
Contexte
Oxyde de baryum
composé chimique De Wikipédia, l'encyclopédie libre
Remove ads
Monoxyde de baryum
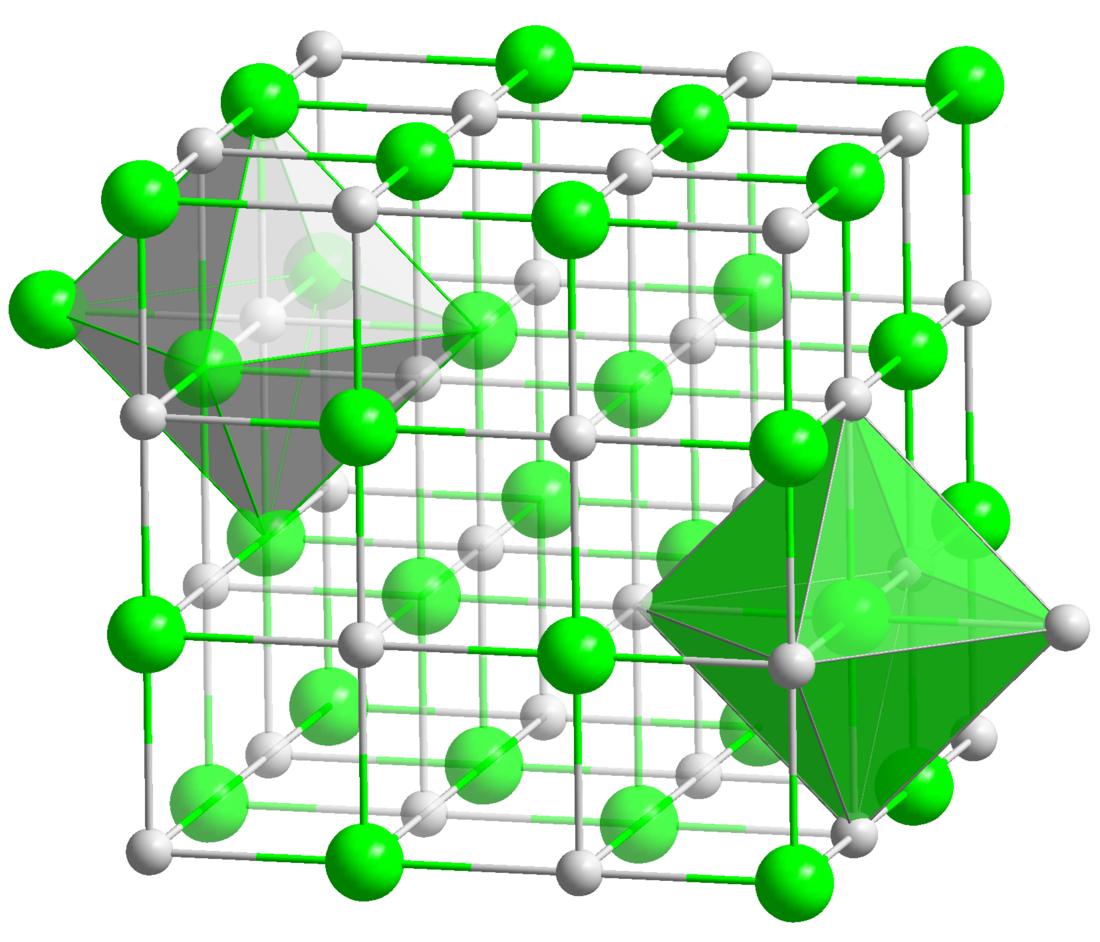
L'oxyde de baryum ou monoxyde de baryum, anciennement dénommé baryte[5], est l'oxyde le plus commun du baryum, de formule BaO[a]. À l'état solide, notamment à température et pression ambiantes, c'est un cristal ionique constitué d'anions oxyde O2− et de cations baryum Ba2+, généralement obtenu sous la forme d'une poudre blanche fortement hydrophile, qui doit donc être conservée à l'abri de l'air.
Remove ads
Réactivité
Ce composé hygroscopique réagit avec l'eau pour former l'hydroxyde de baryum selon la réaction :
- BaO + H2O → Ba(OH)2.
Il peut donner lieu à une explosion au contact de l'humidité, de dioxyde de carbone ou de sulfure d'hydrogène[4].
Fabrication
Il existe plusieurs voies de synthèse, par exemple :
- chauffage d'un mélange de carbonate de baryum avec du coke, du noir de carbone ou du goudron ;
- calcination du nitrate de baryum ;
- calcination du minéral withérite[6] : BaCO3 + chaleur → BaO + CO2 ;
- réaction du baryum avec le dioxygène[7] : 2Ba + O2 + chaleur → 2BaO.
Utilisations
Dans les années 1880, c'était un précurseur dans le procédé de production de dioxygène à haute température dit « procédé Brin », fondé sur les recherches de Thénard et Jean-Baptiste Boussingault[8],[9]. Aujourd’hui, ce protoxyde est utilisé pour le séchage des gaz et solvants[4]. Il sert aussi comme additif dans des verres spéciaux tels les baryum crown et baryum flint.
Dangerosité
L'oxyde de baryum est toxique, corrosif et soluble dans l'eau, et doit donc être manipulé avec d'importantes précautions. Sur la peau et les muqueuses, ce composé peut exercer une action caustique[4].
Notes et références
Articles connexes
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads