Un ión consiste nun átomo ou grupo de átomos dotados de carga eléctrica. Un átomo ou unha molécula, de por si electricamente neutros, transfórmanse en ións cando gañan ou perden electróns. O proceso polo que un átomo ou unha molécula se transforman en ións recibe o nome xenérico de ionización. Ó proceso polo que os ións e os electróns se unen para formar átomos ou moléculas, especies electricamente neutras, recibe o nome de recombinación.

Os ións cargados negativamente, producidos pola ganancia de electróns, reciben o nome de anións e os cargados positivamente, consecuencia dunha perda de electróns, reciben o nome de catións.
Os ións represéntanse da mesma forma que os átomos ou moléculas, pero coa presenza dun expoñente que indica a carga eléctrica neta. Fe3+; OH− representan o ión ferro (III) e o ión hidróxido.
Historia
Os primeiros ións foron teorizados por Michael Faraday arredor de 1830 para describir as porcións en que se dividían as moléculas nos procesos electrolíticos para dirixirse cara aos eléctrodos; o ánodo, eléctrodo cargado positivamente, e o cátodo, cargado negativamente. O mecanismo polo que isto ocorría non foi descrito ata 1884, ano en que Svante Arrhenius o presenta na súa disertación doutoral. Aínda que a teoría de Arrhenius non foi aceptada inicialmente, con posterioridade recibiu o recoñecemento debido outorgándoselle o Premio Nobel de Química de 1903 pola mesma.
Etimoloxía
O termo ión outorgado por Faraday a estas especies químicas provén do grego ἰόν = ion, que significa "o que vai".
Anión significaría: "o que vai cara arriba". Catión: "o que vai cara abaixo". Ánodo: "o camiño cara arriba". Cátodo: "o camiño cara abaixo". (ὁδός odós: camiño, vía).
Formación dos ións
Cando un átomo de sodio perde un electrón dá lugar ó ión (catión) sodio:
- Na → Na+ + 1e−
Cando un átomo de cloro gaña un electrón dá lugar o ión (anión) cloruro:
- Cl + 1e− → Cl−
A rotura ou disociación de moléculas tamén pode dar lugar a ións:
- HCl → H+ + Cl−
A adición dun ión a unha molécula é un mecanismo habitual de formación de ións poliatómicos:
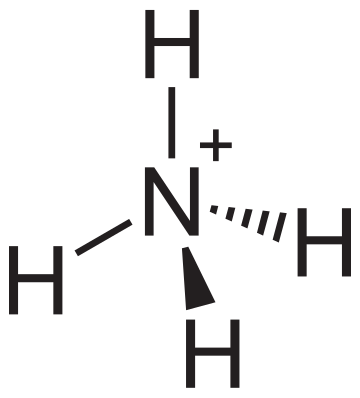
- H+ + NH3 → NH4+
Neste último caso a formación do ión non é debida a ganancia ou perda de electróns por parte do amoníaco (NH3), senón a ganancia dun protón por parte do mesmo. O amoníaco e o ión amonio (NH4+) teñen o mesmo número de electróns, unha capa completa, o que os fai particularmente estables, e diferéncianse no úmero de protóns, tendo o ión amonio un protón máis que electróns o que lle outorga unha carga neta positiva.
Enerxía de ionización
A enerxía necesaria para separar completamente o electrón máis debilmente unido ó resto do átomo, no seu estado fundamental, e de tal xeito que no electrón arrincado non quede ningunha enerxía residual (nin potencial nin cinética) denomináselle primeira enerxía de ionización e o potencial eléctrico equivalente (é dicir, a enerxía dividida pola carga do electrón) coñécese como o potencial de ionización. Estes termos tamén se empregan para describir a ionización das moléculas , pero os valores non son constantes debido a que a ionización pode estar afectada por factores como a temperatura, a química e a xeometría superficial, se se trata dun sólido.
A unidade do sistema internacional de unidades (SI) para a enerxía de ionización é o J/mol, aínda que se usa con máis frecuencia o kJ/mol, cando se refire a cantidades molares y o eV (electrón-voltio) cando se refire a átomos individuais.
Clases de ións
Catións
Son as especies químicas cargadas positivamente. Fórmanse habitualmente cando un átomo ou unha molécula perden electróns.
Anións
Son as especies químicas cargadas negativamente. Fórmanse habitualmente cando un átomo ou unha molécula gañan electróns.
Nos ións negativos, cada electrón do átomo orixinalmente neutro, está fortemente retido pola carga positiva do núcleo. O electrón adicional non está vinculado ó núcleo por forzas de Coulomb, está unido pola polarización do átomo neutro.
Outros ións
- Dianión: Un dianión é unha especie que ten dúas cargas negativas, separadas, sobre ela. Por exemplo: o dianión do pentaleno, que é un hidrocarburo aromático.
- Zwitterión: Un Zwitterión é un ión cunha carga neta igual a cero pero que presenta dúas cargas illadas sobre a mesma especie, unha negativa e outra positiva.
- Radicais iónicos: Son ións que teñen un número irregular de electróns e presentan unha forte inestabilidade e reactividade.

Plasma
Chámaselle plasma a un fluído gasoso formado por ións. Tamén se emprega esta expresión para referirse a mostras de gas corrente que conteñan unha proporción apreciable de partículas cargadas.
Ás veces considérase o plasma como un novo estado da materia, (a parte dos estados sólido, líquido e gasoso), concretamente o cuarto estado da materia, dado que as súas propiedades son moi distintas das dos estados habituais. Os plasmas dos corpos estelares conteñen, de xeito predominante, unha mestura de electróns e protóns, e estímase que constitúe o 99,9% do universo visible.[1]
Algunhas aplicacións dos ións
Os ións son esenciais para a vida. Os ións sodio, potasio, calcio e outros, xogan un papel esencial na bioloxía celular dos organismos vivos, en particular nas membranas celulares. Hai multitude de aplicacións que teñen por base o uso de ións e cada día se descobren máis. Dende detectores de fume a motores iónicos. Os ións inorgánicos disoltos son un compoñente dos sólidos presentes na auga (sólidos totais disoltos) e indican a calidade desta.
Ións máis habituais
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Notas
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.