Solución tampón
From Wikipedia, the free encyclopedia
Remove ads
En química, unha solución tampón[1], sistema amortecedor[2] ou tampón químico (máis precisamente, tampón de pH ou do ión hidróxeno e na literatura inglesa buffer) é unha solución acuosa consistente nunha mestura dun ácido débil e a súa base conxugada ou dunha base débil e o seu ácido conxugado. O pH destas solucións cambia moi pouco cando se lle engaden pequenas cantidades dun ácdo forte ou dunha base forte. As solucións tampón utilízanse para manter o pH a un valor case constante nunha ampla variedade de aplicacións químicas e industriais. Na natureza, hai moitos sistemas que usan estes amortecedores para a regulación do pH. Por exemplo, o sistema tampón bicarbonato utilízase para regular o pH do sangue, mentres que no interior da célula o principal é o tampón fosfato.
Cada sistema amortecedor deste tipo ten o seu propio intervalo efectivo de amortecemento dos cambios de pH, o cal dependerá da constante de equilibrio do ácido ou base empregado. Sistemas tampón típicos son o par amoníaco-catión amonio, ácido acético-anión acetato, anión carbonato-anión bicarbonato, ácido cítrico-anión citrato ou algún dos pares na disociación do ácido fosfórico.
Remove ads
Principios do tamponamento


As solucións amortecedoras ou tampón resisten os cambios de pH debido a que nelas se produce un equilibrio entre o ácido HA e a súa base conxugada A−.
- HA ⇌ H+ + A−
Cando se engade algún ácido forte a unha mestura en equilibrio entre un ácido débil e a súa base conxugada, o equilibrio desprázase á esquerda, de acordo co principio de Le Châtelier. Debido a isto, a concentración de ión hidróxeno increméntanse menos da cantidade agardada tendo en conta a cantidade de ácido forte engadido. Similarmente, se se engade un álcali forte á mestura a concentración e ión hidróxeno diminúe menos da cantidade esperada tendo en conta a acantidade de álcali engadido. O efecto ilústrase pola tritración simulada dun ácido débil cun pKa = 4,7. A concentración relativa de ácido non disociado móstrase en azul e a da súa base conxugada en vermello. O pH cambia de forma relativamente lenta na rexión tampón, pH = pKa ± 1, centrada no pH = 4,7, onde [HA] = [A−]. A concentración de ión hidróxeno diminúe menos do que se esperaría porque a maioría do ión hidróxido engadido se consome na reacción
- OH− + HA → H2O + A−
e só un pouco se consome na reacción de neutralización que é a que tería como resultado un incremento de pH.
- OH− + H+ → H2O
Unha vez que o ácido está desprotonado en máis dun 95%, o pH elévase rapidamente porque a maioría do álcali engadido se consome na reacción de neutralización.
Capacidade de tamponamento
A capacidade de tamponamento ou amortecemento do pH, β, é unha medida cuantitativa da resistencia dunha solución tampón ao cambio de pH coa adición de ións hidróxido. Pode definirse así:
onde dn é unha cantidade infinitesimal de base engadida e d(p[H+]) é o cambio infinitesimal resultante no cologaritmo da concentración de ión hidróxeno. Con esta definición a capacidade de tamponamento dun ácido débil, cunha constante de disociación de ácido Ka, pode expresarse como

onde CA é a concentración analítica do ácido.[3][4] O pH defínese como o −log10[H+]. Esta ecuación mostra que hai tres rexións de aumento da capacidade de tamponamento.
- A p[H+] moi baixo o termo [H+] do denominador predomina e a capacidade de tamponamento elévase exponencialmente coa diminución do pH.
- A capacidade de tamponamento dun axente de tamponamento chega a un máximo local cando p[H+] = pKa. Cae ao 33% do valor máximo a p[H+] = pKa ± 1 e ao 10% a p[H+] = pKa ± 1.5. Por esta razón o intervalo útil é aproximadamente pKa ± 1. A capacidade de tamponamento é proporcional á concentración do axente amortecedor, CA, polo que as solucións diluídas teñen pouca capacidade de tamponamento.
- A p[H+] moi altos o segundo termo do denominador é na práctica constante e a capacidade de tamponamento elévase exponencialmente cun incremento de pH debido ao termo [H+] do numerador; [H+]=10−pH.
As propiedades 1 e 3 son independentes da presenza ou ausencia de axentes tamponantes engadidos. Son efectos da concentración e reflicten que o pH está relacionado co logaritmo da concentración de ión hidróxeno.
Remove ads
Aplicacións
As solucións tampón son necesarias para manter o pH correcto para o funcionamento dos encimas en moitos organismos. Moitos encimas funcionan só en condicións moi precisas; se o pH se move fóra dun estreito intervalo, o encima funciona máis lentamente ou deixa de funcionar e pode desnaturalizarse. En moitos casos a desnaturalización pode eliminar permanentemente a actividade catalítica.[5]
Industrialmente, as solucións tampón son utilizadas nos procesos de fermentación e para establecer as condicións correctas para as tinturas usadas para tinguir tecidos. Tamén se usan en análises químicas[4] e na calibración de pH metros.
A maioría das mostras biolóxicas que se usan en investigación entán feitas en tampóns, especialmente o tampón fosfato salino (PBS, do inglés phosphate buffered saline) a pH 7,4.
No organismo no plasma sanguíneo hai un tampón de ácido carbónico (H
2 CO
3) e bicarbonato (HCO−
3), que mantén o pH entre 7,35 e 7,45. Dentro das células funciona o tampón fosfato.
Axentes tampón simples
Para tampóns nas rexións ácidas, o pH pode ser axustado a un valor desexado engadindo un ácido forte como o ácido clorhídrico a un axente tamponador. Para os tampóns alcalinos, pode engadirse unha base forte como o hidróxido sódico. Alternativamente, unha mestura tampón ou amortecedora pode facerse mesturando un ácido e a súa base conxugada. Por exemplo, un tampón acetato pode facerse pola mestura de ácido acético e acetato de sodio. Similarmente, un tampón alcalino pode facerse a partir dunha mestura dunha base e o seu ácido conxugado.
Mesturas tampón "universais"
Combinando substancias con valores de pKa que difiren en só dous ou menos e axustando o pH, pode obterse unha ampla variedade de tampóns. O ácido cítrico é un compoñente útil dunha mestura porque ten tres valores de pKa, separados por menos de dous. O rango de tampón pode ser ampliado engadindo outros axentes tamponadores. As seguintes mesturas (solucións tampón McIlvaine) teñen un rango de tamponamento do pH 3 ao 8.[6]
Pode facerse unha mestura que conteña ácido cítrico, fosfato de monopotasio, ácido bórico e ácido dietil barbitúrico para cubrir o intervalo de pH do 2,6 ao 12.[7]
Outros tampóns universais son o tampón Carmody[8] e o tampón Britton-Robinson, desenvolvido en 1931.
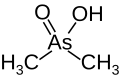
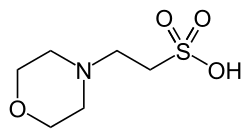
Compostos tampón comúns usados en bioloxía
Para os rangos efectivos ver capacidade de tamponamento, arriba.
Remove ads
Cálculo do pH do tampón
Ácidos monopróticos
A expresión do equilibrio é
- HA ⇌ A− + H+
Isto mostra que cando o ácido se disocia prodúcense cantidades iguais de ión hidróxeno e do anión. As concentracións de equilibrio destes tres compoñentes poden calcularse nunha táboa ICE, siglas de "iniciais" (condicións), "cambio" e "equilibrio".
Na primeira fila, denominada I, indícanse as condicións iniciais: a concentración de ácido é C0, inicialmente non disociado, polo que a concentración de A− e H+ sería cero; y é a concentración inicial de ácido forte "engadido", como o ácido clorhídrico. Se se engade un álcali forte, como o hidróxido de sodio y terá un signo negativo porque o álcali retira ións hidróxeno da solución. A segunda fila, denominada C por cambio, especifica os cambios que ocorren cando o ácido se disocia. A concentración de ácido diminúe nunha cantidade de −x e as concentracións de A− e H+ increméntanse ambas nunha cantidade de +x. Isto derívase da expresión de equilibrio. A terceira fila, denominada E por concentracións de equilibrio, engádese conxuntamente as dúas primeiras filas e mostra as concentracións no equilibrio.
Para calcular x, úsase a fórmula para a constante de equilibrio en termos de concentracións:
Substitúense as concentracións cos valores atopados na última fila da táboa ICE:
Simplifícase a:
Con valores específicos para C0, Ka e y esta ecuación pode resolverse para x. Como o pH = −log10[H+], o pH pode calcularse como pH = −log10(x + y).
Ácidos polipróticos

Os ácidos polipróticos son ácidos que poden peder máis dun protón. A constante de disociación do primeiro protón pode indicarse como Ka1 e as constantes de disociación dos sucesivos protóns como Ka2 etc. O ácido cítrico, H3A, é un exemplo de ácido poliprótico, xa que pode perder tres protóns.
Cando a diferenza entre sucesivos valores de pKa é menor de tres hai solapamento entre os rangos de pH de existencia das especies en equilibrio. Canto menor é a diferenza, maior é o solapamento. No caso do ácido cítrico, o solapamento é amplo e as solucións de ácido cítrico son tamponadas no seu rango completo do pH 2,5 ao 7,5.
O cálculo do pH cun ácido poliprótico require realizar uns cálculos de especiación. No caso do ácido cítrico, isto implica a solución das dúas ecuacións de equilibrio de masas seguintes
CA é a concentración analítica do ácido, CH é a concentración analítica dos ións hidróxeno engadidos, βq son as constantes de asociación acumulativas
Kw é a constante de autoionización da auga. Hai dúas ecuacións simultáneas non lineares en dúas cantidades descoñecidas [A3−] e [H+]. Disponse de moitos programas informáticos para facer este cálculo. O diagrama de especiación do ácido crítico obtívoe usando o programa HySS.[10]
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
![{\displaystyle \beta ={\frac {dn}{d(\mathrm {p[H^{+}]} )}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8b6a0d9cf94cad0bf43f4458260f05388fab9a73)
![{\displaystyle {\frac {dn}{d(\mathrm {pH} )}}=2.303\left({\frac {C_{\mathrm {A} }K_{\mathrm {a} }[\mathrm {H^{+}} ]}{\left(K_{\mathrm {a} }+[\mathrm {H^{+}} ]\right)^{2}}}\right)}](http://wikimedia.org/api/rest_v1/media/math/render/svg/791d0525b0bccad3eed5bc0f7c3acff3d54c530c)









![{\displaystyle K_{\mathrm {a} }={\frac {[\mathrm {H^{+}} ][\mathrm {A^{-}} ]}{[\mathrm {HA} ]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/4d45faa1d34eda090e28481c7a733292d0afface)


![{\displaystyle C_{\mathrm {A} }=[\mathrm {A^{3-}} ]+\beta _{1}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]+\beta _{2}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{2}+\beta _{3}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{3}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/453bf576ebd25ff5786b09befaeb5156931890c3)
![{\displaystyle C_{\mathrm {H} }=[\mathrm {H^{+}} ]+\beta _{1}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]+2\beta _{2}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{2}+3\beta _{3}[\mathrm {A^{3-}} ][\mathrm {H^{+}} ]^{3}-K_{\mathrm {w} }[\mathrm {H^{+}} ]^{-1}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/370946cab85c802fb49f8bc89440e432011bfbc9)
