שאלות נפוצות
ציר זמן
צ'אט
פרספקטיבה
מלח (כימיה)
תרכובת יונית, המורכבת מקטיונים ומאניונים מוויקיפדיה, האנציקלופדיה החופשית
Remove ads
בכימיה מלח הוא כל תרכובת המורכבת מקטיונים (יונים בעלי מטען חשמלי חיובי) ומאניונים (יונים בעלי מטען שלילי), באופן שהמטען הכולל של התרכובת הוא נייטרלי. לפיכך בכל מלח יחס האניונים לקטיונים הוא קבוע, על פי מטענם. המלח מכונה לעיתים חומר יוני בגלל הרכבו. לרוב הקטיונים מופיעים כיסוד מתכתי והאניונים מופיעים כיסוד אל-מתכתי.

בשפת היום-יום המושג "מלח" משמש לציון מלח הבישול או בשם נתרן כלורי (תרכובת של נתרן וכלור) – אף שזו רק דוגמה אחת מני רבות לקבוצת החומרים הנקראים מלחים.
Remove ads
תכונות
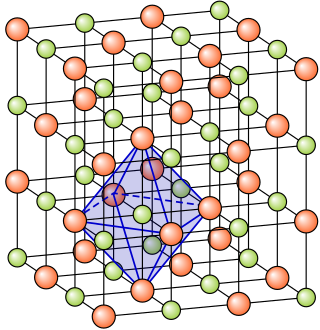
היונים במלח מסתדרים כך שמרחקם של הקטיונים זה מזה ושל האניונים זה מזה הוא הגדול ביותר, בעוד מרחקם של האניונים מן הקטיונים קטן. מבנה זה הוא גבישי ונקרא סריג יוני. הקשר הכימי בין היונים השונים הוא קשר חזק מאוד ומכונה קשר יוני. קשר זה מקנה למלחים טמפרטורת התכה גבוהה במיוחד. חוזקם הפיזי של המלחים נמוך ודחיסותם נמוכה.
כשהמלח מתגבש בצורתו הטהורה הוא הופך לקובייה שקופה וצלולה.[1]
Remove ads
קלי-תמס וקשי-תמס
סכם
פרספקטיבה
מלחים מתמוססים במים לרוב בעקבות יון מסוים ההופך את כל המלחים המורכבים ממנו לקלי-תמס. דוגמאות ליונים כאלו: יונים הנוצרים ממתכות אלקליות, וגם ניטראט או אמוניום . מלחים מסוימים קלי-תמס או קשי-תמס בשל שילוב מסוים של קטיונים ואניונים.
אפשר לחלק את המלחים לשתי קבוצות על פי מידת התמוססותם במים (אם כי החלוקה לשתי קבוצות מסיסות גסה מעיקרה, ולא תמיד שימושית כשמדובר בחומרים שמסיסותם בינונית):
- קלי-תמס – מסיסים במים. כאשר מלח קל-תמס מתמוסס במים, האניונים והקטיונים אשר מרכיבים אותו נפרדים בשל הקשרים שנוצרים ביניהם ובין החלקים הטעונים במלקולות המים. סביב כל יון מסתדרות מולקולות המים כך שצד אחד שלהן פונה ליון: הצד השלילי – אזור אטום החמצן – ליונים החיוביים, והצד החיובי – אזור אטומי המימן – ליונים השליליים. נוסף על המולקולות בקרבת היון, מולקולות נוספות מסתדרות בהתאם, ונוצרות שכבות הקרויות שכבות מִיּוּם; המבנה כולו נקרא כדור מיום, והיון קרוי "יון ממוים". נוכחות היונים בתמיסה מאפשרת הולכת חשמל.
- קשי-תמס – מסיסותם במים מזערית.
Remove ads
תגובות שבהן נוצרים מלחים
סכם
פרספקטיבה
מלחים הם לרוב תוצרים של פעילויות כימיות בין החומרים האלה:
- תגובה המתרחשת בין חומצה לבסיס; תגובה כזו נקראת תגובת סתירה. חומצה ובסיס יוצרים מלח ומים. דוגמאות: נתרן גופרתי: 2NaOH + H2SO4 → Na2SO4 + 2H2O. אמוניה וחומצת מימן כלורי: NH3 + HCl → NH4Cl. את הגדרת המלח כתוצר התגובה שבין בסיס לחומצה קבע במאה ה־18 הכימאי רואל (Guillaume François Rouelle) שהיה מורהו של לבואזיה.[2] תוצר הסתירה שבין חומצה חזקה לבסיס חזק הוא מלח נייטרלי; תגובה בין חומצה חזקה לבסיס חלש נותנת מלח חומצי; תגובת בסיס חזק עם חומצה חלשה נותנת מלח בסיסי.
- מתכת וחומצה יוצרים מלח וגז מימן. דוגמה: מגנזיום גופרתי: Mg + H2SO4 → MgSO4 + H2.
- מתכת וחומר מחמצן למשל
תגובת שיקוע
 ערך מורחב – תגובת שיקוע
ערך מורחב – תגובת שיקוע
מלחים קשי-תמס יכולים להיווצר כאשר מערבבים מלחים קלי-תמס שונים באותה תמיסה. היונים השונים מתערבבים ואם שילוב מסוים של אניונים וקטיונים יוצר מלח קשה-תמס, הוא ישקע.
מינוח
מלחים נקראים על שם היונים המרכיבים אותם (למשל ליתיום פלואורי). בדומה לכתיב הכימי החלק הראשון בשם המלח הוא הקטיון (לרוב יון המתכת או יון אמוֹניוּם), ואחריו האניון. קבוצת מלחים המכילים יון מסוים יכולה להיקרא בשם היון.
לדוגמה:
- קרבונט הוא מלח של חומצה פחמתית: נתרן פחמתי, למשל.
- כלוריד הוא מלח של חומצה הידרוכלורית: אשלגן כלורי, למשל. ובכלל, הליד הוא מלח של חומצה הלוגנית.
- ציאניד הוא מלח של חומצה הפרוידיאנית (ציקלון בה): אשלגן ציאני, למשל.
- חנקה (ניטרט) הוא מלח של חומצה חנקתית: אשלגן חנקתי, למשל.
- זרחה (פוספט) הוא מלח של חומצה זרחתית: פוספיט הוא מלח של חומצה זרחתית.
- סולפט הוא מלח של חומצה גופרתית: סולפיט הוא מלח של חומצה גופריתית; סולפיד הוא מלח של חומצה גופרית.
Remove ads
קישורים חיצוניים
- מלח, באתר אנציקלופדיה בריטניקה (באנגלית)
 מלחים, דף שער בספרייה הלאומית
מלחים, דף שער בספרייה הלאומית
הערות שוליים
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

![{\displaystyle {\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}{\vphantom {A}}^{-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/02e54ddd1b0acf2c3e42d87536ab09fab46126d4)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}{\vphantom {A}}^{+}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2bb0139af26d177bc7aef69678645cd7fe1aaee6)
![{\displaystyle {\mathrm {Ca} {}+{}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {CaCl} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2dc3a655e7c833aa1b3766bfce26c458d77f1edd)