Top Qs
Timeline
Obrolan
Perspektif
Barium sulfida
senyawa kimia Dari Wikipedia, ensiklopedia bebas
Remove ads
Barium sulfida adalah sebuah senyawa anorganik dengan rumus kimia BaS. BaS adalah senyawa barium yang diproduksi dalam skala terbesar.[3] Senyawa ini merupakan prekursor penting untuk senyawa barium lainnya, termasuk barium karbonat dan pigmen litopon, ZnS/BaSO4.[4] Seperti kalkogenida lain dari logam alkali tanah, BaS merupakan pemancar gelombang pendek untuk layar elektronik.[5] Senyawa ini tidak memiliki warna, meskipun seperti kebanyakan sulfida lainnya, umumnya diperoleh dalam bentuk tak murni yang memiliki warna.
Remove ads
Penemuan
Ringkasan
Perspektif
BaS dibuat oleh alkimiawan Italia Vincenzo Cascariolo (juga dikenal sebagai Vincentius atau Vincentinus Casciarolus atau Casciorolus, 1571–1624) melalui reduksi termokimia BaSO4 (tersedia sebagai mineral barit).[6] Saat ini, senyawa ini diproduksi melalui versi perbaikan dari proses Cascariolo menggunakan kokas sebagai pengganti tepung dan arang. Konversi semacam ini disebut reaksi karbotermik:
- BaSO
4 + 2C → BaS + 2CO
2
dan juga:
- BaSO
4 + 4C → BaS + 4CO
Metode dasarnya masih digunakan hingga saat ini. Senyawa ini larut dalam air. Larutan berair ini, ketika direaksikan dengan natrium karbonat atau karbon dioksida, akan menghasilkan padatan barium karbonat berwarna putih, bahan sumber untuk banyak senyawa barium komersial.[7]
Menurut Harvey (1957),[8] pada tahun 1603, Vincenzo Cascariolo menggunakan barit, yang ditemukan di kaki Gunung Paterno dekat Bologna, dalam salah satu usahanya yang gagal menghasilkan emas. Setelah menggiling dan memanaskan mineral tersebut dengan arang dalam kondisi reduksi, dia memperoleh suatu material luminesen persisten yang kemudian dikenal sebagai Lapis Boloniensis, atau batu Bologna.[9][10] Fosforesensi material yang diperoleh Casciarolo menjadikannya sebuah keingintahuan.[11][12][13]
Remove ads
Pembuatan
Prosedur modern menggunakan barium karbonat:[14]
- BaCO
3 + H
2S → BaS + H
2O + CO
2
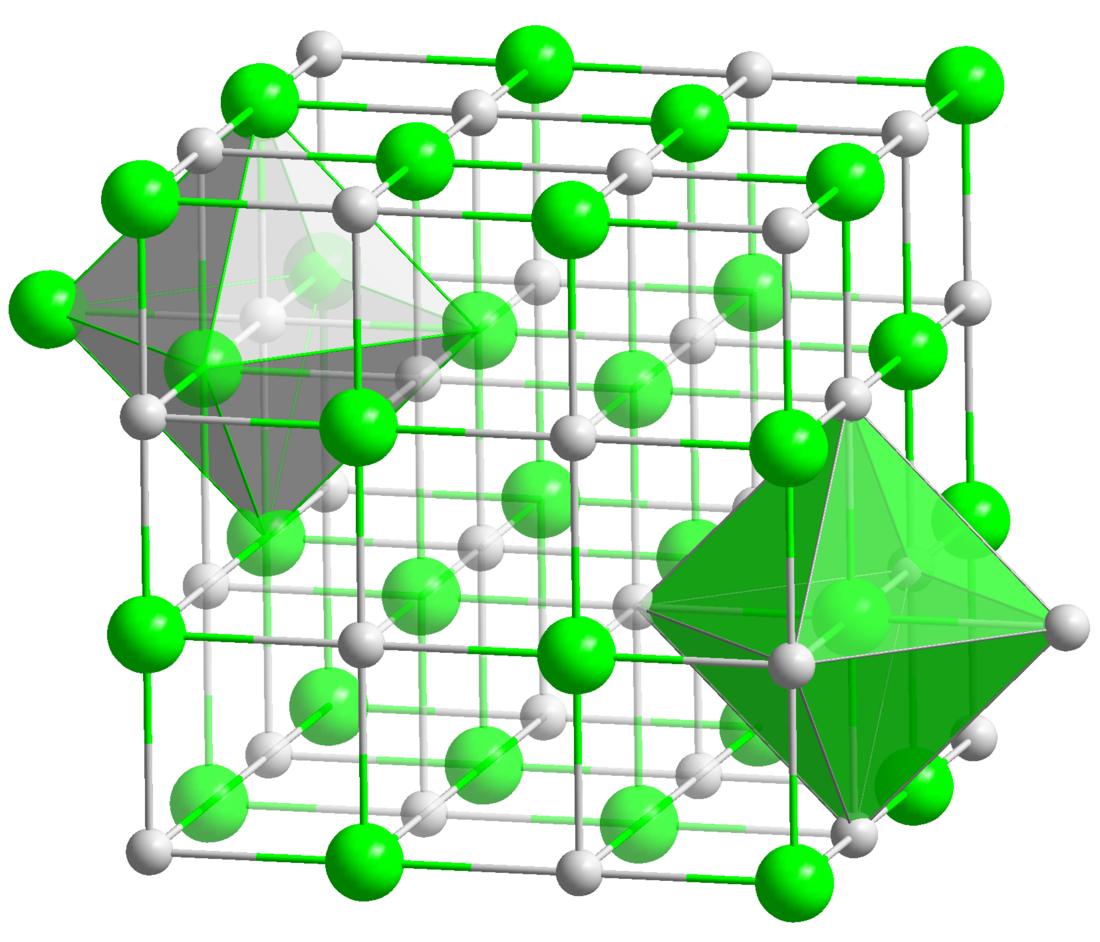
BaS mengkristal dengan struktur NaCl, yang memiliki pusat Ba2+ dan S2− oktahedral.
Titik lebur barium sulfida yang teramati sangat sensitif terhadap pengotor.[2]
Keamanan
BaS cukup beracun, begitu pula dengan senyawa sulfida terkait, seperti CaS, yang akan menghasilkan hidrogen sulfida beracun saat berkontak dengan air. Barium sendiri juga beracun.
Referensi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads