Timeline
Chat
Prospettiva
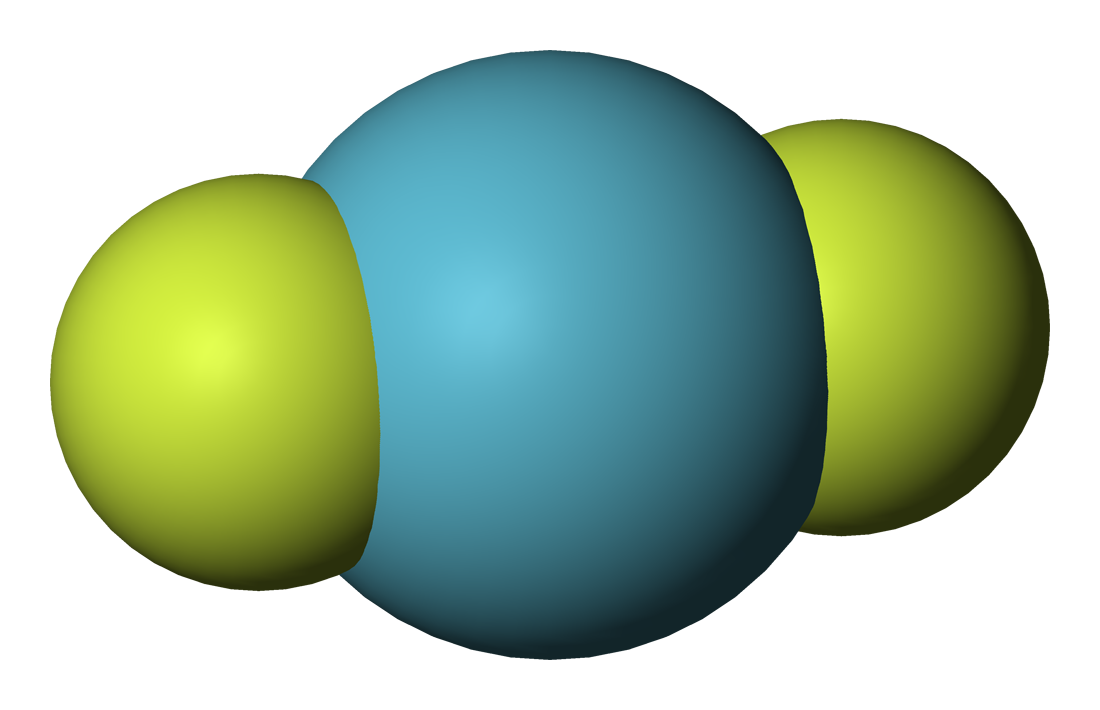
Difluoruro di kripton
composto chimico Da Wikipedia, l'enciclopedia libera
Remove ads
Il difluoruro di kripton è un composto chimico binario del kripton(II) con il fluoro, avente formula chimica KrF2. È un composto isoelettronico di valenza al più noto difluoruro di xenon, ma molto meno stabile di quest'ultimo ed è uno dei più forti ossidanti che si conoscano.[2]
È stato il primo composto del kripton ad essere stato scoperto.[3] Si presenta come un solido cristallino incolore e volatile. Reagisce con forti acidi di Lewis per formare complessi dei cationi molecolari KrF+ e Kr2F+3.[4]
Remove ads
Proprietà e struttura
Il difluoruro di kripton, diversamente dal difluoruro di xenon (ΔHƒ° = -164 kJ/mol), è un composto endotermico, ΔHƒ° = +60 kJ/mol ed anche alquanto meno stabile cineticamente, tendendo a decomporsi sopra a 0°C.[5] Lo si può ottenere sottoponendo a scariche elettriche una miscela di kripton e fluoro a -183 °C.[6]
Il difluoruro di kripton allo stato solido è dimorfico, con una fase alfa, più stabile alle temperature più basse, e una fase beta, più stabile a quelle più alte, indicativamente sopra a circa -80 °C.[7] In quest'ultima la cella elementare è tetragonale a corpo centrato. La molecola KrF2 risulta essere lineare, come atteso dal modello VSEPR, e la distanza Kr−F è di 188,9 pm,[7] sensibilmente più corta di quella Xe–F (197,73 pm).[8]
Remove ads
Reazioni
Riepilogo
Prospettiva
Il difluoruro di kripton è un potentissimo ossidante e fluorurante, portando gli elementi a stati di ossidazione non comuni. È risaputo come una soluzione acquosa concentrata di HCl e HNO3 (≈ 3:1, detta Acqua regia) riesca ad ossidare l'oro da Au0 ad Au3+; a contatto con un forte eccesso di KrF2 l'oro passa da stato di ossidazione 0 a +5 secondo la seguente reazione:
Portando il sale ottenuto ad una temperatura compresa tra i 60 e i 65 °C, esso si decompone e in tal modo fornisce il potente acido di Lewis pentafluoruro aurico AuF5:[6][9]
Questo può anche essere usato per ossidare/fluorurare lo xenon fino al suo esafluoruro:[10]
3 KrF2 + Xe → XeF6 + 3 Kr
La reazione di KrF2 con il pentafluoruro di antimonio fornisce il sale [KrF]+[SbF6]−:[4]
KrF2 + SbF5 → [KrF]+[SbF6]−
In questa forma il catione KrF+ riesce ad ossidare/fluorurare gli alogeni centrali in BrF5 e in ClF5 allo stato di ossidazione +7, dando rispettivamente [BrF6]+[SbF6]− e [ClF6]+[SbF6]−.[2][11]
KrF2 può ossidare/fluorurare l'argento metallico non solo a Ag(II) dando AgF2,[6] ma anche fino a Ag(III) dando il trifluoruro AgF3.[12][13]
Remove ads
Note
Bibliografia
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


![{\textstyle {\ce {2 Au + 7 KrF2 -> 5 Kr + 2[KrF]+[AuF6]-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8145c1c0f61ddcd3cb3e2c468f75bc30b508ba0e)
![{\textstyle {\ce {[KrF]+[AuF6]- ->[calore] AuF5 + Kr + F2}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/5e50a5333dae16503a146c56aaab965b80b3a882)