Timeline
Chat
Prospettiva
Ditionato
ossoanione di zolfo Da Wikipedia, l'enciclopedia libera
Remove ads
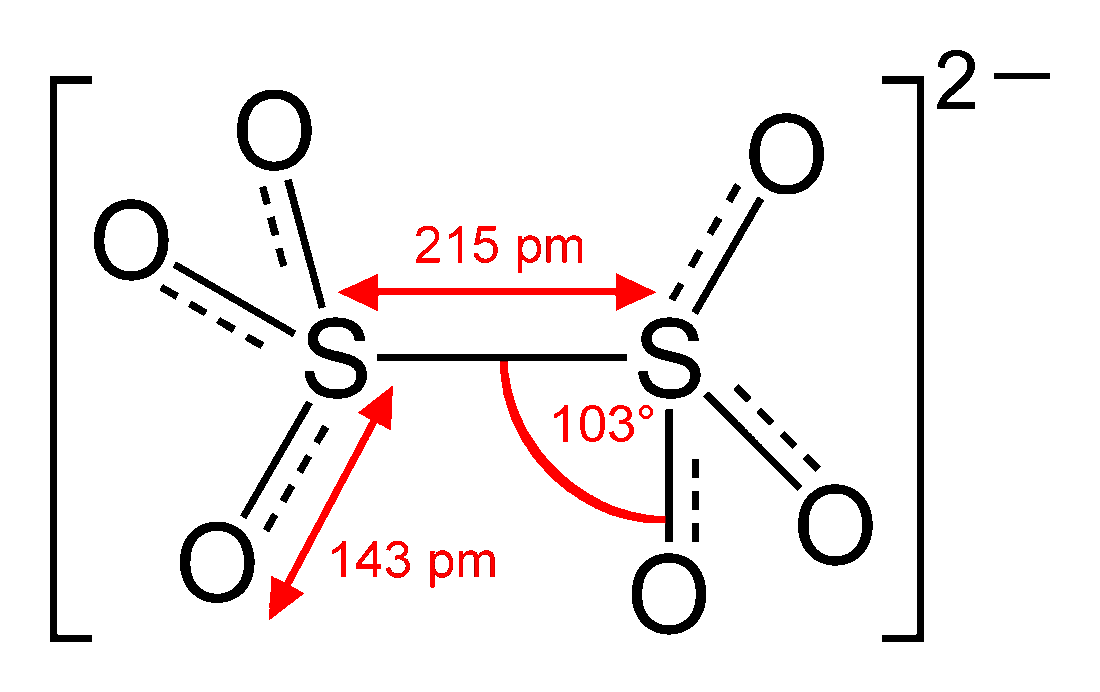
Lo ione ditionato (nome tradizionale e IUPAC) è un ossoanione di formula S2O2−6, la cui struttura è −O3S−SO3−;[1] la sua massa molecolare è 160,13 u. Un altro suo nome sistematico è esaossodisolfato(V). Questo ione è il membro zero dei politionati, nei quali sono inseriti n atomi di zolfo tra due gruppi terminali SO3−; pertanto la loro formula generale è −O3S−Sn−SO3−, dove n può anche arrivare a 20.[2]

Deriva dalla doppia deprotonazione dell'acido ditionico (H2S2O6, noto solo in soluzione)[3] e, formalmente, dall'addizione di anidride solforosa allo ione solfato (SO2 + SO42− → S2O2−6).
Lo zolfo è qui esavalente come nel solfato ma, data la presenza del legame S−S), ha numero di ossidazione +5, invece che +6.[4] In presenza di forti ossidanti o riducenti prende parte a reazioni di ossidoriduzione formando solfato, solfito o ditionito. La specie è sufficientemente stabile dal punto di vista cinetico da permettere di bollire le sue soluzioni acquose senza che si decomponga.
Viene preparato per ossidazione della SO2 con biossido di manganese in soluzione acquosa a ≈ 0 °C:[4]
Poi l'anione viene precipitato come BaS2O6 (sale poco solubile) e il precipitato viene addizionato di acido solforico in quantità equimolecolare, ottenendo così una soluzione acquosa concentrata di acido ditionico:[5]
Remove ads
Note
Bibliografia
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
![{\displaystyle {2\,\mathrm {MnO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}3\,\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {Mn} {\vphantom {A}}^{2+}{}+{}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{\vphantom {A}}^{2-}{}+{}\mathrm {S} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{\vphantom {A}}^{2-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/19612eec8448bbfd40105f8580f43c912f87eeb0)
![{\displaystyle {\mathrm {BaS} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\longrightarrow } {}\mathrm {BaSO} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {S} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{6}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f82752c006c4a1499c09b2eb9a77eab9415f2465)