トップQs
タイムライン
チャット
視点
アジ化水素
ウィキペディアから
Remove ads
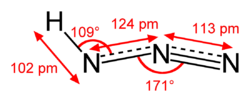
アジ化水素(—かすいそ、英語: hydrogen azide)は、化学式が HN3 で表される無機酸の一種[2]。アジ化水素酸(英語: hydrazoic acid)、アゾイミド(英語: azoimide)[3]とも呼ばれる。刺激臭を有する無色透明の液体。爆発性を有する。CAS登録番号は [7782-79-8]。
シアン化水素(青酸)並みの猛毒で、皮膚、粘膜などを刺激する。取り扱いには適切な設備と厳重な管理を要する。
Remove ads
歴史
アジ化水素は1890年、テオドール・クルチウスにより最初に単離された[4]。
化学的性質
アジ化水素は弱酸性を持つ (pKa 4.6–4.7)。水に溶けやすく、水溶液は多くの金属(亜鉛、鉄など)を、水素を放出しながら溶かす。そのとき、金属のアジ化物を生成する。
多くの金属アジ化物には爆発性が知られる。また、無水物の結晶は加熱により分解し、金属の純品を与える。鉛や銀、水銀のアジ化物は水に難溶であり、そのことはハロゲン化水素とアジ化水素との類似点である。アジ化物はまた、ヨウ化アルキルと容易に反応する。
カルボン酸ハロゲン化物やアルデヒド、ケトンなどに作用させると、シュミット反応を引き起こす。
製造
アジ化水素はアジ化ナトリウムなどの塩に酸を作用させて得る。
毒性
毒性は青酸に匹敵し、後遺症の報告もある[5]。アジ化水素は揮発性と高い毒性を持つ。蒸気を吸い込むと、刺激臭を感じるとともに激しい頭痛に見舞われる。蓄積性はない。
アジ化ナトリウムが胃酸と反応し、アジ化水素を発生させ、治療者に二次被害を与える危険性がある[6]。日本でも、医療スタッフに二次被害が発生した事例がある[6]。
脚注
関連項目
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads