トップQs
タイムライン
チャット
視点
単鎖可変領域フラグメント
ウィキペディアから
Remove ads
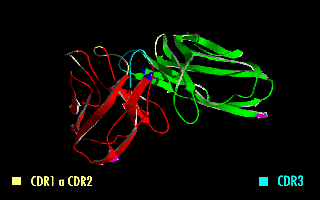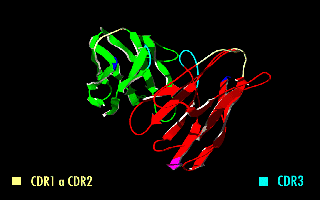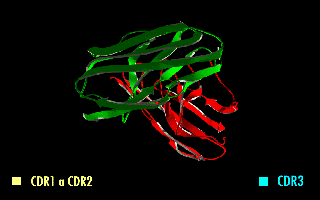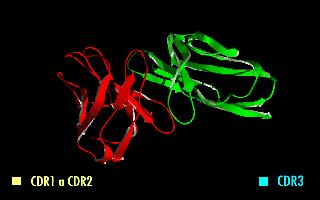
単鎖可変領域フラグメント(たんさかへんりょういきフラグメント、英: single-chain variable fragment、scFv)は、免疫グロブリンの重鎖(VH)および軽鎖(VL)の可変領域を、10~25アミノ酸程度の短いリンカーペプチドで繋いだ融合タンパク質である[1]。したがって、実際には抗体フラグメントではない。リンカーは通常、柔軟性のためにグリシンを、また溶解性のためにセリンまたはスレオニンを多く含み、VHのN末端とVLのC末端をつないだり、またはその逆の場合もある[2]。このタンパク質は、定常領域の除去とリンカーの導入にもかかわらず、元の免疫グロブリンの特異性を保持している[3]。右の画像は、通常、この修正によって特異性が変化しないことを示している。


これらの分子は、ファージディスプレイを容易にするために作成された。ファージディスプレイは、抗原結合ドメインを単一のペプチドとして発現することが非常に便利である。別の方法として、ハイブリドーマに由来するサブクローン化された重鎖および軽鎖からscFvを直接作成することもできる。scFvには、フローサイトメトリー、免疫組織化学、人工的T細胞受容体(キメラ抗原受容体)の抗原結合ドメインなど、多くの用途がある。
哺乳類の細胞培養で作られることが多いモノクローナル抗体とは異なり、scFvは大腸菌などの細菌の細胞培養で作られることが多い[3]。
Remove ads
精製
単鎖可変領域フラグメントは、完全な抗体分子に見られる定常Fc領域を持たないため、共通の結合部位(プロテインGなど)を使用して抗体を精製することはできない。プロテインLはκ軽鎖(カッパ軽鎖)の可変領域と相互作用するため、これらのフラグメントはプロテインLを使用して精製または固定化することがよくある。より一般的には、scFv分子のC末端に6つのヒスチジンタグを組み込み、固定化金属アフィニティークロマトグラフィー(IMAC)を使用してそれらを精製する。ヒトVH3ドメインを含む一部のscFvも、プロテインAによって捕捉される[4]。
2価および3価のscFv

2価(divalent or bivalent)の単鎖可変領域フラグメント(di-scFv、bi-scFv)は、2つのscFvを連結することで設計できる。2つのVH領域と2つのVL領域を持つ単一のペプチド鎖を生成することで、タンデム型scFvを得ることができる[5][6]。もう一つ考えられるものは、2つの可変領域を一緒に折りたたむには短すぎるリンカーペプチド(約5アミノ酸)を持つscFvを作成し、scFvを強制的に二量体化することである。この種類は二重特異性抗体(ダイアボディ、diabody)として知られている[7]。ダイアボディは、対応するscFvよりも解離定数が最大40倍低いことが示されており、これは標的に対する親和性が非常に高いことを意味している。その結果、ダイアボディ薬は、他の治療用抗体よりもはるかに少ない投与量で、生体内の腫瘍を高い特異性で標的にすることができる[8]。さらに短いリンカー(1個または2個のアミノ酸)は、三量体、いわゆるトリアボディ(triabody)やトリボディ(tribody)の形成につながる。四量体であるテトラボディ(Tetrabody)も作られている。それらは標的に対してダイアボディよりもさらに高い親和性を示す[9]。
これらの形式はすべて、2つの異なる抗原に特異性を持つ可変フラグメントから構成でき、その場合、いずれも二重特異性抗体の一種である[10][11]。その中でも最も開発が進んでいるのが、二重特異性T細胞エンゲージャー(BiTE抗体構築物)として知られている二重特異性タンデムdi-scFvである。
Remove ads
事例
脚注
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads