トップQs
タイムライン
チャット
視点
水素化ナトリウム
ナトリウムの水素化物 ウィキペディアから
Remove ads
水素化ナトリウム(すいそかナトリウム、sodium hydride)は、化学式 NaH で表されるナトリウムの水素化物である。有機合成において強塩基として用いられる[5]。純粋なものは白色だが、市販品は灰色である。
Remove ads
構造と特徴
要約
視点
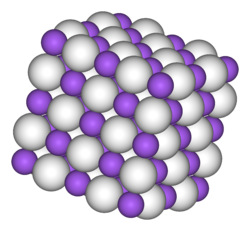
他のアルカリ金属の水素化物と同じく固体はイオン結合性が強く、結晶構造は塩化ナトリウム型構造である。結晶格子中で は6個の に囲まれた八面体型の構造をとっている。NaH 中の のイオン半径は146pm と見積もられている[6]。これは のイオン半径 133pm に近い。
多くの試薬会社から、60% のオイルディスパージョン(鉱油混合物)の形で販売されている。このようなディスパージョンは純粋な固体よりも取り扱いが安全である。ヘキサンなどで鉱油を洗い流してから使用することもある。
インバース水素化ナトリウム
インバース水素化ナトリウムと呼ばれる化合物は、 と によって構成されている。 はアルカリドの一つで、この化合物は通常とは異なり水素からナトリウムへと電子が移動するため、非常に高いエネルギーを蓄えている。インバース水素化ナトリウムの誘導体の生成にはアダマンザンが用いられ、アダマンザンは を不可逆的に閉じ込めることで の影響を妨げている。理論的には、剥き出しのプロトン化第三級アミンとナトリウムアルカリドの錯体でさえも特定の溶媒中では準安定となるだろうと考えられている。しかし、これらのイオンの反応障壁は非常に小さく、また適切な溶媒を見付けるのは恐らく困難である。
Remove ads
反応性と用途
要約
視点
可燃性の高い腐食性の化合物で、著しい弱酸である水素 (H2) (pKa = 35) の共役塩基であるヒドリド (H−) が強い塩基性を示す。水との接触によって加水分解され水素と水酸化ナトリウムが発生するが、ほとんどの場合爆発的に反応が起こる。また、炭素の存在下では一酸化炭素や二酸化炭素ガスが生成することもある。一般的な溶媒にはほとんど溶けないため、反応は固体表面のみで起こる。通常はテトラヒドロフランやジメチルホルムアミド中で使われる。
主として有機合成で、アルコールやフェノールのOH基、ピラゾールなどのNH基、チオールのSH基といったブレンステッド酸からプロトンを引き抜くのに用いられる。マロン酸エステルなど 1,3-ジカルボニル化合物のCHプロトンを引き抜くのにもよく利用される。生成するナトリウム塩はアルキル化などに使われる。縮合反応用の試薬としても広く用いられ、ディークマン縮合、シュトッベ縮合、ダルツェン縮合、クライゼン縮合などが例として挙げられる。
ジメチルスルホキシドとともに加熱すると、可溶性の塩基が生成する[7]。
この塩基は硫黄イリドを調製してケトンをエポキシドに変換する反応(コーリー・チャイコフスキー反応)に用いられる。ウィッティヒ反応用のリンイリドの調製に使われることもある。
また、ジシランやジスルフィドの Si−Si、S−S 結合を還元する。他の場合で水素化ナトリウムが金属ナトリウムの還元力を上回る反応性を示すことは稀である。
Remove ads
製造
鉱油中に金属ナトリウムの微粉末を懸濁させたもの、または溶融させたナトリウムに対し、水素ガスを通じて得る[8]。
- 250℃で熱分解が始まり、425℃で解離圧が1気圧となる。[1]
参考文献
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads