トップQs
タイムライン
チャット
視点
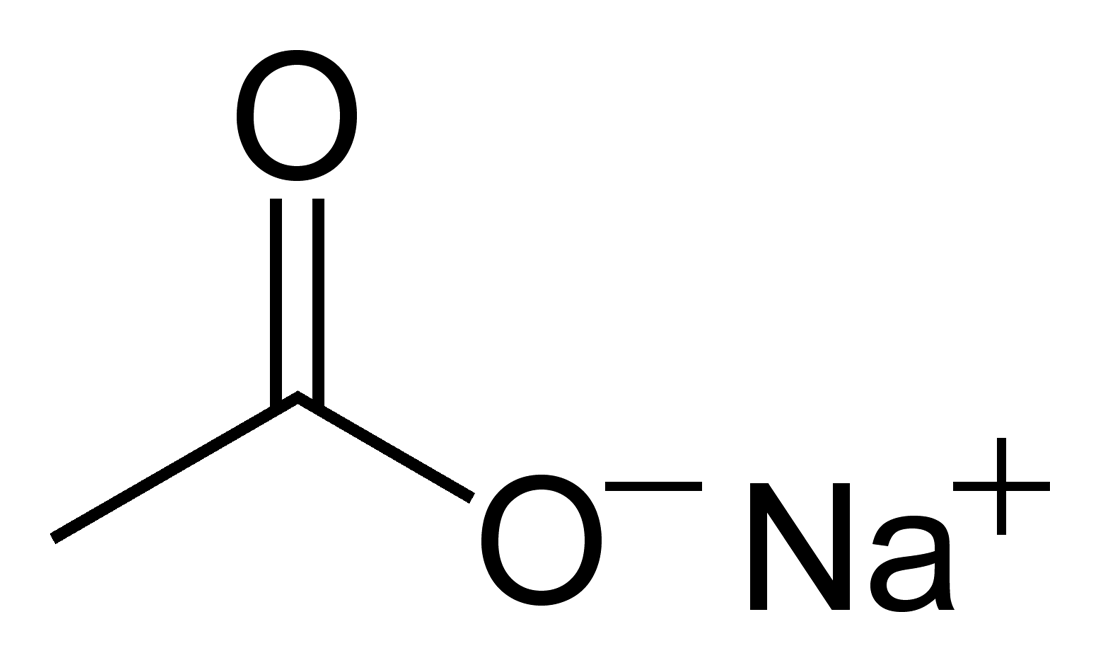
酢酸ナトリウム
酢酸とナトリウムのつくる塩 ウィキペディアから
Remove ads
酢酸ナトリウム(さくさんナトリウム、Sodium acetate)とは、酢酸とナトリウムのつくる塩である。酢酸ソーダとも言う。無水物と三水和物が存在する。

無水物、三水和物ともに無色の結晶である。
無水物、三水和物ともに水によく溶けるが、有機溶媒にはほとんど溶けない。弱酸と強塩基の塩なので、水溶液は弱アルカリ性を示す。
酢酸と水酸化ナトリウムまたは炭酸ナトリウムの中和により三水和物が得られ、この三水和物を120 °C – 250 °Cで加熱すると無水物となる。
Remove ads
用途
緩衝溶液の調製、染料の媒染剤に用いられるほか、融解熱が大きいので暖房器具の蓄熱、保温材としても使われる。漬物などの保存料がわりに使われることもある。
またポテトチップスの一部に酢酸ナトリウムが酸味として用いられる。[9]
蓄熱
酢酸ナトリウムは、蓄熱、エコカイロに使われている。酢酸ナトリウムの過飽和水溶液は結晶化によって相当な発熱を生じる。
酢酸ナトリウムの三水和物の結晶は58–58.4 °C (136.4–137.1 °F)で融解し[10][11]、液体酢酸ナトリウムは解放された結晶水に溶ける。融点を超えて加熱し、その後冷却させると、水溶液は過飽和状態になる。この水溶液は、結晶を形成することなく室温まで冷却することができる(過冷却)。カイロ内の金属片を押すことにより、核生成中心が形成され、溶液が結晶化して固体の酢酸ナトリウム三水和物に戻る。結晶化のプロセスは発熱反応である[12]。 融解熱は約264〜289kJ/kg(73〜80Wh/kg)である[10]。不可逆的な化学反応に依存するものなど、いくつかのタイプのカイロとは異なり、酢酸ナトリウムカイロは、結晶が完全に溶解するまで、沸騰したお湯に数分間浸し、ゆっくりと室温まで冷却させることによって、簡単に再利用することができる[13]。
三水和物の熱伝導率が0.2W/mKと水の1/3程度しか無いのが弱点。[14]
- カイロと、封入されているコイン状衝撃材
- 結晶化の様子
Remove ads
過冷却(過飽和)
酢酸ナトリウムの過冷却温度は-10℃を容易に下回る。[15]
過冷却現象を利用することで断熱なしで熱を蓄え、衝撃を与えることで必要な時に熱を取り出せる。
一方で常時安定して高い温度を供給することを求められる暖房用の蓄熱装置としては好ましくない。
核生成剤を添加することで過冷却を抑制できる。[16][17]
能動的には、超音波や電圧印加で過冷却を解除できる。[18]
ちなみに、厳密に言えば酢酸ナトリウムの過冷却は水に本来の溶解度を超えて酢酸ナトリウムが溶けている過飽和現象である。水のような単体の過冷却とは仕組みが異なる。[19]約60%より濃度が低い酢酸ナトリウム溶液で過冷却が破れた場合、液体の飽和溶液と固体の酢酸ナトリウム三水和物結晶にわかれる。(相分離)[17]
合成・反応
要約
視点
合成
反応
酢酸ナトリウムを水酸化ナトリウムとともに強熱すると、メタンが得られる。
脚注
関連項目
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads