상위 질문
타임라인
채팅
관점
단백질생성성 아미노산
아미노산의 부류 위키백과, 무료 백과사전
Remove ads
단백질생성성 아미노산(영어: proteinogenic amino acid)은 번역 과정에서 단백질의 생합성에 사용되는 아미노산이다. "단백질생성성(proteinogenic)"이라는 단어는 "단백질 생성(protein creating)"을 의미한다. 알려진 모든 생물체에서 22가지의 유전적으로 암호화된(단백질생성성) 아미노산이 있으며, 표준 유전 부호로 20가지, 특수 번역 메커니즘에 의해 통합될 수 있는 2가지(셀레노시스테인 및 피롤리신)이 있다.[1] 표준 아미노산(영어: common amino acid)이라고도 한다.

대조적으로 단백질비생성성 아미노산은 단백질에 통합되지 않거나(GABA, L-도파 또는 트라이아이오도티로닌과 같은) 유전적으로 암호화된 아미노산 대신 잘못 통합되거나 세포에 의해 직접적으로 분리되거나 생성되지 않는 아미노산(예: 하이드록시프롤린)이다. 후자는 보통 단백질의 번역 후 변형으로 인해 발생한다. 일부 단백질비생성성 아미노산은 비리보솜 펩타이드 합성효소에 의해 합성되는 비리보솜 펩타이드에 통합된다.
진핵생물과 원핵생물 모두 SECIS 요소로 알려진 뉴클레오타이드 서열을 통해 셀레노시스테인을 단백질에 통합시킬 수 있으며, 이는 세포가 근처의 UGA 코돈을 셀레노시스테인(UGA는 일반적으로 종결 코돈)으로 번역하도록 지시한다. 일부 메테인생성 원핵생물에서 UAG 코돈(일반적으로 종결 코돈)은 피롤리신으로 번역될 수도 있다.[2]
진핵생물에는 표준 유전 부호의 20가지 아미노산에 셀레노시스테인을 더한 21가지의 단백질생성성 아미노산이 있다. 사람은 이들 단백질생성성 아미노산들 중 12가지를 서로 간 또는 다른 대사 중간생성물로부터 합성할 수 있다. 나머지 9가지는 음식물로부터 섭취해야 하기 때문에(보통 단백질 유도체로) 필수 아미노산이라고 한다. 필수 아미노산은 히스티딘, 아이소류신, 류신, 리신, 메티오닌, 페닐알라닌, 트레오닌, 트립토판, 발린이다.[3]
단백질생성성 아미노산은 리보자임의 자동아미노아실화 시스템에 의해 인식될 수 있는 아미노산의 세트와 관련이 있는 것으로 밝혀졌다.[4] 따라서 단백질비생성성 아미노산은 뉴클레오타이드 기반 생명체의 우발적인 진화적 성공에 의해 제외되었을 것이다. 특정 단백질비생성성 아미노산이 일반적으로 단백질에 통합되지 않는 이유를 설명하기 위해 다른 이유들이 제시되었다. 예를 들어 오르니틴과 호모세린은 펩타이드 골격에 대해 고리를 형성하고 상대적으로 짧은 반감기로 단백질을 파편화하는 반면, 다른 것들은 아르기닌 유사체인 카나바닌과 같이 단백질에 실수로 통합될 수 있기 때문에 독성이 있다.
원시 수프에서 특정 단백질생성성 아미노산의 진화적 선택은 단백질비생성성 아미노산과 달리 폴리펩타이드 사슬에 더 잘 통합되기 때문인 것으로 제안되었다.[5]
Remove ads
구조
다음 그림은 진핵생물의 유전 부호에 의해 단백질 합성에 직접적으로 사용되는 21가지 아미노산들의 구조와 약어이다. 그림에 나타난 구조는 수용액에서 존재하는 일반적인 양쪽성 이온의 형태가 아닌 표준 화학 구조이다.
 |
IUPAC 및 IUBMB는 현재 다음의 두 가지 아미노산에 대한 표준 약어도 권장한다.
Remove ads
화학적 특성
요약
관점
다음은 표준 아미노산의 한 문자 기호, 세 문자 기호 및 곁사슬의 화학적 특성을 나열한 표이다. 표시된 질량은 자연 존재비에서 동위원소의 가중 평균을 기반으로 한다. 펩타이드 결합을 형성하면 물 분자가 제거된다. 따라서 단백질의 질량은 펩타이드 결합당 18.01524 Da을 뺀 값으로 구성된 아미노산들의 질량과 같다.
일반 화학적 특성
곁사슬의 특성
§: 아스파르트산(Asp), 시스테인(Cys), 글루탐산(Glu), 히스티딘(His), 리신(Lys), 티로신(Tyr)에 대한 값은 알라닌 펜타펩타이드의 중앙에 배치된 아미노산 잔기를 사용하여 결정되었다.[6] 아르기닌(Arg)에 대한 값은 페이스(Pace) 등의 저자들의 논문(2009)[7]을 참조하였다. 셀레노시스테인(Sec)에 대한 값은 변(Byun)과 강(Kang)의 논문(2011)[8]을 참조하였다.
N.D.: 피롤리신의 pKa값은 보고되지 않았다.
주: 작은 펩타이드에 있는 아미노산 잔기의 pKa값은 일반저으로 단백질 내부에 있을 때와 약간 다르다. 이러한 상황에서 아미노산 잔기의 pKa값의 변화를 계산하기 위해 단백질 pKa 계산이 때때로 사용된다.
유전자 발현 및 생화학
* UAG는 일반적으로 앰버 종결 코돈이지만 pylTSBCD 유전자 클러스터에 의해 암호화되는 생물학적 시스템을 포함한 생물에서는 피롤리신을 지정한다.[9]
** UGA는 일반적으로 오팔(또는 엄버) 종결 코돈이지만 SECIS 요소가 있는 경우 셀레노시스테인을 지정한다.
† 종결 코돈은 아미노산을 지정하지는 않지만 완전성을 위해 포함시킨다.
†† UAG 및 UGA가 항상 종결 코돈으로 작용하는 것은 아니다(위 참조).
‡ 필수 아미노산은 인체에서 합성할 수 없기 때문에 반드시 음식물로 섭취해야 한다. 조건부 필수 아미노산은 일반적으로 식단에 필요하지 않지만 적절한 양으로 합성되지 않는 특정 개체군에게는 외부로부터 공급되어야 한다.
& 아미노산의 존재 여부는 각각 135가지의 고세균 프로테옴, 3,775가지의 세균 프로테옴, 614가지의 진핵생물 프로테옴 및 사람의 프로테옴(21,006가지의 단백질)을 기반으로 한 것이다.[10]
질량분석법
펩타이드와 단백질의 질량분석법에서 잔기의 질량에 대한 지식은 유용하다. 펩타이드 또는 단백질의 질량은 잔기의 질량과 물의 질량의 합(단일 동위원소 질량 = 18.01056 Da, 평균 질량 = 18.0153 Da)이다. 잔기의 질량은 화학식 및 원자량으로부터 계산된다.[11] 질량분석법에서 이온은 하나 이상의 양성자를 포함할 수도 있다(단일 동위원소 질량 = 1.00728 Da, 평균 질량* = 1.0074 Da). *양성자는 평균 질량을 가질 수 없다. 이것은 중양성자를 유효한 동위원소로 혼란스럽게 추론하지만, 이들은 다른 화학종이어야 한다(히드론을 참조).
§ 단일 동위원소 질량
세포의 화학량론 및 대사 비용
아래의 표는 대장균 세포에서의 풍부한 아미노산과 아미노산 합성을 위한 대사 비용(ATP)을 나열한 것이다. 음수는 대사 과정이 에너지적으로 유리하고 세포의 순ATP를 소모하지 않음을 나타낸다.[12] 풍부한 아미노산은 유리된 형태와 중합된 형태(단백질)의 아미노산을 포함한 것이다.
비고
이화작용
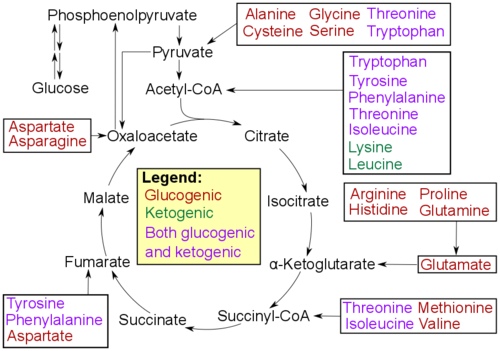 |
아미노산은 주요 생성물의 특성에 따라 다음과 같이 분류할 수 있다.[13]
- 포도당생성성 아미노산 – 포도당신생합성에 의해 포도당으로 전환될 수 있는 아미노산이다.
- 케톤체생성성 아미노산 – 케톤체의 전구체인 아세틸-CoA로 직접적으로 분해될 수 있는 아미노산이다. 이들은 케톤체생성 또는 지질 합성에 사용될 수 있다.
- 포도당생성성 아미노산이면서 케톤체생성성 아미노산이기도 한 아미노산
Remove ads
같이 보기
각주
참조 문헌
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads