상위 질문
타임라인
채팅
관점
미오글로빈
단백질의 종류 위키백과, 무료 백과사전
Remove ads
미오글로빈(영어: myoglobin, Mb 또는 MB)은 일반적으로 척추동물과 거의 모든 포유류의 심장근 및 골격근 조직에서 발견되는 철 결합 단백질 및 산소 결합 단백질이다.[5][6][7][8][9] 미오글로빈은 헤모글로빈의 소단위체와 구조적으로 유사하다. 헤모글로빈에 비해 미오글로빈은 산소에 대한 친화력이 더 크며 헤모글로빈처럼 산소와 협동적으로 결합하지 않는다.[8][10] 미오글로빈은 글로불린의 핵심에 비극성 아미노산으로 구성되어 있으며, 여기서 헴기는 미오글로빈의 주변 폴리펩타이드와 비공유결합적으로 결합되어 있다. 사람의 경우 미오글로빈은 근육 손상 후 혈류에서만 발견된다.[11][12][13]
근육 세포의 미오글로빈 농도가 높으면 생물체가 더 오랫동안 숨을 참을 수 있다. 고래나 물개와 같은 잠수 포유류는 특히 미오글로빈이 풍부한 근육을 가지고 있다.[13] 미오글로빈은 I형 근육, II형 A 근육, II형 B 근육에서 발견된다. 많은 문헌에서는 미오글로빈이 평활근에서 발견되지 않는다고 하지만 이는 잘못된 것으로 판명되었으며 평활근에도 미오글로빈이 존재한다.[14]
미오글로빈은 X선 결정학을 통해 3차원 구조가 밝혀진 최초의 단백질이다.[15] 이러한 성과는 1958년에 존 켄드루와 동료들에 의해 보고되었다.[16] 이러한 발견으로 존 켄드루는 맥스 퍼루츠와 함께 1962년에 노벨 화학상을 수상했다.[17][18] 미오글로빈은 생물학에서 가장 많이 연구된 단백질 중 하나임에도 불구하고, 그 생리학적 기능은 아직 확실하게 정립되지 않았다. 미오글로빈이 부족하도록 유전적으로 조작된 쥐는 생존 가능하고 번식력이 있을 수 있지만 이러한 손실을 극복하기 위해 많은 세포 및 생리학적 적응을 보여준다. 미오글로빈이 고갈된 생쥐에서 이러한 변화를 관찰함으로써 미오글로빈의 기능이 근육으로의 산소 운반 증가 및 산소 저장과 관련이 있다는 가설이 세워졌다. 또한 미오글로빈은 활성 산소를 제거하는 역할도 한다.[19]
사람의 경우 미오글로빈은 MB 유전자에 의해 암호화된다.[20]
미오글로빈은 옥시미오글로빈(MbO2), 카복시미오글로빈(MbCO), 메트미오글로빈(met-Mb)의 형태를 취할 수 있으며, 이는 옥시헤모글로빈(HbO2), 카복시헤모글로빈(HbCO), 메트헤모글로빈(met-Hb) 형태를 취하는 헤모글로빈과 유사하다.[21]
Remove ads
헤모글로빈과의 차이점
헤모글로빈과 마찬가지로 미오글로빈은 헴기에 산소를 결합시키는 세포질 단백질이다. 미오글로빈에는 글로불린 그룹이 1개만 있는 반면 헤모글로빈에는 4개가 있다. 미오글로빈의 헴기는 헤모글로빈의 헴기와 동일하지만, 미오글로빈은 헤모글로빈 보다 산소에 대한 친화력은 크지만 총 산소 저장 용량은 적다.[22] 최신 발견에 따르면 미오글로빈은 기울기에 따라 산소 확산을 촉진하여 미토콘드리아에서 산소 운반을 향상시킨다.
요리에서의 역할
미오글로빈에는 붉은 고기의 색을 담당하는 색소인 헴이 포함되어 있다. 고기의 색은 부분적으로 미오글로빈의 산화 정도에 따라 결정된다. 신선한 고기에서 철 원자는 산소 분자(O2)와 결합한 제일철(+2) 산화 상태에 있다. 잘 익힌 고기가 갈색인 이유는 철 원자가 전자를 잃어 제이철(+3) 산화 상태로 전환되기 때문이다. 고기가 아질산염에 노출되면 철 원자가 산화 질소(예: 콘드 비프 또는 절인 햄)에 결합되어 있기 때문에 분홍색으로 유지된다. 구운 고기는 일산화 탄소에 결합하는 헴 중심에서 나오는 붉은 분홍색 "연기 고리(smoke ring)"를 나타낼 수도 있다.[23] 일산화 탄소로 포장된 생고기도 동일한 원리로 인해 분홍색 연기 고리가 나타난다. 특히 이 생고기의 표면 역시 핑크색을 띠고 있는데, 이는 일반적으로 소비자들이 신선한 고기를 떠올리는 것과 관련되어 있다. 이렇게 인위적으로 유도된 분홍색은 최대 1년까지 지속될 수 있다고 한다.[24] 호멜과 카길(미국의 육류 가공 회사) 모두 이러한 육류 포장 공정을 사용한다고 보고되었으며, 이러한 방식으로 처리된 육류는 2003년부터 시장에 출시되었다.[25]
대체육은 미오글로빈과 연관된 "고기" 맛을 재현하기 위해 다양한 방법을 사용해왔다. 임파서블 푸즈는 콩의 뿌리혹에서 추출한 헴을 함유한 글로빈인 레그헤모글로빈을 사용하는데, 이는 효모인 코마가타엘라에서 재조합 단백질로 생산된다.[26][27] 모티프 푸드웍스(Motif FoodWorks)는 미국 식품의약국(FDA)에서 GRAS로 간주하는[28] 코마가타엘라 효모를 사용하여 재조합 소 미오글로빈(bovine myoglobin)을 생산한다.[29] 무렉 사이언스(Moolec Science)는 "피기 수이(Piggy Sooy)"라 불리는 씨앗에서 돼지 미오글로빈을 생성하는 콩을 개발했다. 피기 수이는 2024년 4월에 미국 농무부(USDA)에서 승인되었다.[30]
Remove ads
질병에서의 역할
미오글로빈은 미오글로빈 농도가 매우 높은 손상된 근육 조직에서 방출(횡문근융해증)된다.[31] 방출된 미오글로빈은 신장에 의해 여과되지만 신세뇨관 상피에 독성이 있기 때문에 급성 신장 손상을 일으킬 수 있다.[32] 독성이 있는 것은 미오글로빈 그 자체가 아니라(프로톡신) 산성 환경(예: 산성 소변, 리소좀)에서 미오글로빈에서 해리되는 페리헤메이트(ferrihemate) 부분이다.
미오글로빈은 근육 손상에 대한 민감한 지표로, 흉통 환자의 심근 경색의 위험성에 대한 잠재적인 지표가 된다.[33] 그러나 증가된 미오글로빈은 급성 심근 경색(AMI)에 대한 특이성이 낮으므로 진단을 위해서는 CK-MB, 심장 트로포닌, 심전도(ECG) 및 임상 징후를 고려해야 한다.[34]
구조 및 결합
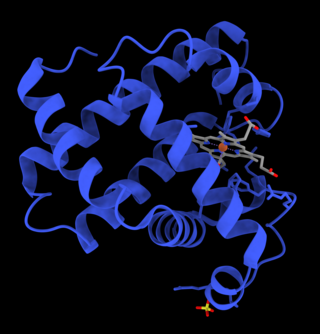
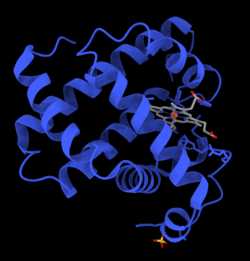
미오글로빈은 단백질의 글로빈 슈퍼패미리에 속하며 다른 글로빈과 마찬가지로 루프로 연결된 8개의 α 나선으로 구성된다. 미오글로빈은 153개의 아미노산으로 구성된다.[35]
미오글로빈은 가운데에 철이 있는 포르피린 고리를 함유하고 있다. 근위 히스티딘 그룹(His93)은 철에 직접적으로 부착되고, 원위 히스티딘 그룹(His64)은 반대쪽 면 근처에 맴돌고 있다.[35] 원위 이미다졸은 철에 결합되지 않지만, 기질인 O2와 상호작용을 할 수 있다. 이러한 상호작용은 산소(O2)와의 결합을 촉진하지만 일산화 탄소(CO)는 여전히 O2보다 약 240배 더 강하게 결합한다.
O2의 결합은 Fe 중심에서 상당한 구조적 변화를 일으키며, 이는 반경이 줄어들고 N4 포켓의 중심으로 이동한다. O2 결합은 "스핀 페어링(spin-pairing)"을 유도한다. 5배위 철 디옥시 형태는 높은 스핀이고 6배위 옥시 형태는 낮은 스핀과 반자성이다.
- 미오글로빈의 Fe-O2 상호작용에 대한 분자 궤도 설명[36]
- 이것은 산화된 미오글로빈 분자의 이미지이다. 이미지는 산소가 헴 보결분자단의 철 원자에 결합될 때의 구조적 변화를 보여준다. 산소 원자는 녹색, 철 원자는 빨간색, 헴기는 파란색으로 표시되어 있다.
- 미오글로빈
Remove ads
합성 유사체
전이 금속 이산소 착물에 대한 광범위한 관심의 일부로 미오글로빈의 많은 모델들이 합성되었다. 잘 알려진 예는 테트라페닐포르피린의 입체적으로 부피가 큰 유도체의 철 복합체로 구성된 피켓 펜스 포르피린(picket fence porphyrin)이다.[37] 이미다졸 리간드가 있는 경우 이 철 복합체는 O2와 가역적으로 결합한다. O2 기질은 구부러진 형상을 채택하여 철 중심의 6번째 위치를 차지한다. 이 모델의 핵심적인 특성은 비활성 이철 상태인 μ-옥소 이합체의 느린 형성이다. 본질적으로 이러한 비활성화 경로는 Fe-포르피린 집합체의 근접 접근을 방지하는 단백질 매트릭스에 의해 억제된다.[38]
 |
Remove ads
같이 보기
각주
더 읽을거리
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads