상위 질문
타임라인
채팅
관점
수소 스펙트럼 계열
위키백과, 무료 백과사전
Remove ads
수소의 방출 스펙트럼(영어: Hydrogen spectral series)은 스펙트럼 선들의 개수로 나뉜다. 물리학에서는 수소의 스펙트럼은 전자와 에너지 레벨 사이의 입자 점프들과 일치한다. 수소원자의 가장 간단한 모델은 보어 모델로 주어진다. 전자가 높은 에너지에서 낮은 에너지로 점프할 때 뚜렷한 파장의 광자는 뤼드베리 공식에 의해 방출된다.

(n은 처음에너지 레벨이고 n'는 마지막 에너지 레벨이다. 그리고 R은 뤼드베리 상수)
스펙트럼 선들은 n'을 따라 그룹지어진다. 선들은 묶음의 긴파장/작은 진동수로부터 순차적으로 이름 붙여진다. 각각 그리스 문자로 쓰여진다. 예를 들면 2->1 선은 "리만 알파" (Ly-α), 7->3 선은 "파셴 델타" (Pa-δ)로 불린다. 몇몇 수소 스펙트럼 선들은 이 묶음들의 바깥으로 떨어진다. 이 같은 것을 21cm 선이라 하고 매우 희귀한 미세한 흔들림과 같은 사건이다.
Remove ads
계열
요약
관점
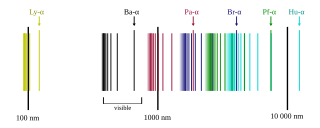
수소 스펙트럼의 모든 파장 영역은 다음과 같다.
라이먼 계열 (n′ = 1)
발머 계열 (n′ = 2)

파셴 계열 (n′ = 3)
브래킷 계열 (n′ = 4 )
푼트 계열 (n′ = 5)
1924년 푼트가 마이크로파 영역에서 관측.
험프리 계열 (n′ = 6)
그 이상 (n′ > 6)
이름지어지지 않음. 그러나 뤼드베리 방정식과 같은 패턴이다.
Remove ads
같이 보기
- 천문 분광법
- 보어의 이론과 발머-뤼드베리 방정식
- 모즐리의 법칙
- 이론적 슈뢰딩거 방정식에 대한 실험 정당화
외부 링크
- (영어) Bigs animation Spectral series of hydrogen
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


 ,
,  ...
...