상위 질문
타임라인
채팅
관점
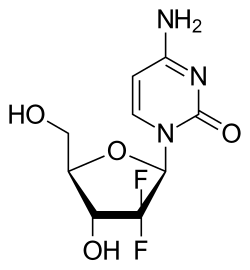
젬시타빈
항암제의 일종 위키백과, 무료 백과사전
Remove ads
젬시타빈(Gemcitabine)은 화학요법 약물이다. 젬자(Gemzar) 등의 상품명으로 판매된다.[1] 고환암,[2] 유방암, 난소암, 비소세포폐암, 췌장암, 방광암 등의 암 치료에 사용한다.[3][4] 정맥 주사로 투여한다.[3] 인터페론 신호 전달의 상향 조절을 통해 종양 성장을 억제하고 E형 간염의 원인 바이러스인 오르토헤페바이러스 A의 복제를 억제한다.[5]
비교적 흔한 부작용으로는 골수 억제, 간 및 신장 문제, 메스꺼움, 발열, 발진, 호흡곤란, 구강 궤양, 설사, 신경병증, 탈모 등이 있다.[3] 임신 중에 사용하면 태아에 해를 끼칠 수 있다.[3] 젬시타빈은 뉴클레오사이드 유사체 약물 계열에 속한다.[3] 새로운 DNA의 생성을 차단하여 세포 사멸을 일으키는 방식으로 작동한다.[3]
젬시타빈은 1983년에 특허를 받았고 1995년에 의료용으로 승인되었다.[6] 복제약은 2009년에는 유럽에, 2010년에는 미국에서 도입되었다.[7][8] WHO 필수 의약품 목록에 포함되어 있다.[9]
Remove ads
의학적 사용
젬시타빈은 여러 가지 암종의 치료에 사용된다. 단독으로 사용할 시 췌장암의 일차 치료제로, 시스플라틴과 병용할 때는 말기나 전이성 비소세포폐암과 방광암의 치료에 쓸 수 있다. 카보플라틴과 병용할 경우 난소암의, 파클리탁셀과 병용할 경우 전이했거나 수술로 제거가 불가능한 유방암의 치료에 사용한다.[10][11][12]
부작용
젬시타빈은 분열 중인 어떤 세포든 죽여서 작용하는 항암제이다.[10] 따라서 빠르게 분열하는 암세포가 젬시타빈의 표적이 되는 비율이 높은 것이다. 그러나 피부, 두피, 위장관벽, 골수 등 빠르게 분열하는 몸의 정상 세포들 역시 젬시타빈의 표적이 되므로 부작용을 일으킬 수 있다.[15]:265
젬시타빈의 라벨에서는 젬시타빈이 골수 기능을 억제하여 백혈구감소증, 혈소판감소증, 그리고 적혈구 손실로 인한 빈혈 등을 일으킬 수 있으며, 간이나 신장, 심혈관계 질환이 있는 환자에서는 조심하여 사용해야 한다는 경고를 포함하고 있다. 또한 젬시타빈을 투여 받고 있는 환자는 생백신을 접종 받아서는 안된다. 한편 경고 라벨에서는 젬시타빈이 가역적 후두부 뇌병증 증후군, 모세혈관 누출 증후군, 혹은 폐부종, 폐렴, 성인 호흡곤란 증후군과 같은 심각한 폐 질환 원인이 될 수 있으며 정자에도 유해할 수 있다고 기술하고 있다.[10][16]
투여 받은 사람 중 10% 이상에서 호흡곤란, 적혈구와 백혈구, 혈소판의 감소, 구역질과 구토, 트랜스아미네이스 증가 (간 효소 수치 증가), 발진과 가려움증, 탈모, 혈뇨와 단백뇨, 독감 유사 증상, 부종 등이 발생한다.[10][17]
투여 받은 사람의 1~10% 정도에서 발생하는 흔한 부작용에는 발열, 식욕부진, 수면장애, 두통, 피로감, 기침, 콧물, 설사, 입과 입술의 염증, 발한, 요통, 근육통이 있다.[10]
혈전성 혈소판감소성 자반증 (TTP)는 드물지만 심각한 부작용으로, 젬시타빈과 같은 특정 항암제를 복용했을 때 나타날 수 있다. TTP는 혈액 질환이며 미세혈관병용혈빈혈 (MAHA), 신경학적 이상,발열, 신장병 등으로 이어질 수 있다.[18]
Remove ads
금기증 및 상호작용
젬시타빈 투여는 남성과 여성의 생식 기능, 성생활, 생리 등에 영향을 미칠 수 있다. 젬시타빈을 투여 받고 있는 여성은 임신해서는 안되며, 임신했거나 수유 중인 여성은 젬시타빈 투여의 금기증이 된다.[17]
약리학
젬시타빈은 친수성으로, 뉴클레오사이드 수송체를 통해 세포 안으로 수송되어야 한다. 젬시타빈이 이용하는 가장 흔한 수송체는 SLC29A1, SLC28A1, SLC28A3 등이 있다.[19][20] 세포 안으로 들어온 젬시타빈은 우선 인산기가 붙어 젬시타빈 일인산(gemcitabine monophosphate, dFdCMP)이 된다.[19][20] 이 과정은 디옥시사이티딘 인산화효소(DCK)가 촉매하며, 전체 과정의 속도 결정 단계에 해당한다.[19][20] 다른 효소에 의해 dFdCMP에 두 개의 인산기가 더 붙는다. 세 개의 인산기가 붙은 젬시타빈은 젬시타빈 삼인산(gemcitabine triphosphate, dFdCTP)이 되어 약리학적으로 활성을 가진다.[19][21]
세 번 인산화된 젬시타빈은 디옥시사이티딘 삼인산을 흉내내어, 세포가 복제되면서 새로운 DNA 가닥을 합성할 때 대신 기질로 사용된다.[3][19][20] 젬시타빈이 DNA로 들어와도 정상적인 뉴클레오사이드가 그 이후로 계속 들어올 수 있다. 젬시타빈은 가짜 염기지만, 이웃한 정상 뉴클레오사이드로 인해 세포의 복구 과정(염기절제수선)을 회피할 수 있게 되고, 복제 과정은 젬시타빈이 가려진 채 종결된다. (masked chain termination) 따라서 젬시타빈이 세포의 DNA에 들어가면 복구 불가능한 오류가 생기고 추가적인 DNA 합성이 억제되어, 결국 세포의 사멸로 이어진다.[3][19][20]
젬시타빈에 인산기가 두 개만 붙은 젬시타빈 이인산 (dFdCDP) 역시 활성을 가지는데, 새로운 DNA 뉴클레오타이드를 만드는 데에 필요한 효소인 리보뉴클레오타이드 환원효소(RNR)을 억제한다. 뉴클레오타이드가 고갈되면 세포가 뉴클레오타이드 합성에 필요한 물질을 더 많이 세포 바깥에서 섭취한다.[3][19][20][22]
Remove ads
화학
젬시타빈은 합성 약물로, 피리미딘 뉴클레오사이드 전구약물이며 뉴클레오사이드 유사체에 속한다. 디옥시사이티딘의 2' 탄소에 붙어 있는 수소 원자가 플루오린 원자로 대체되어 있다.[3][23][24]
아래에 기술된 합성 과정은 일라이 릴리 앤드 컴퍼니 연구실에서 본래 수행했던 합성 과정이다. 합성 과정은 광학 이성질체 순수(enantiopure) D-글리세르알데하이드 (R)-2에서 시작하며, 이 물질은 D-만니톨에서 2~7단계를 거쳐 만들 수 있다. 그 후 에틸 브로모다이플루오로아세트산을 사용하여 플루오린을 도입한다. 다음으로는 표준 조건 하에서의 레포르마츠키 반응을 통해 3:1 anti/syn 부분입체 이성질체 혼합물이 만들어지며, 이 중 anti 쪽이 원하는 생산물이다. HPLC를 통해 부분입체 이성질체를 분리할 수 있으며, 이를 통해 수율 65%로 anti-3 젬시타빈을 얻는다.[23][24] 최소한 두 가지의 서로 다른 완전한 합성 과정이 다른 곳에서도 개발되었다.[24]

Remove ads
역사
젬시타빈은 일라이 릴리 앤드 컴퍼니의 래리 헤르틸(Larry Hertel) 연구실에서 1980년 초반 처음으로 합성하였다. 처음 의도한 것은 항바이러스제로서의 효능이었으나, 전임상시험 결과 in vitro 환경에서 백혈병 세포를 죽이는 것이 밝혀졌다.[25]
1990년대 초반 들어 임상시험을 통해 젬시타빈 관련 연구가 진행되었다. 췌장암 임상시험에서 젬시타빈은 1년 생존률을 크게 늘려주는 것이 밝혀졌다. 그 결과 1995년 영국에서 췌장암에 대한 사용 승인을 받았고[10] FDA는 1996년 췌장암에 대한 사용 허가를 냈다.[4] 1998년, FDA에서는 젬시타빈을 비소세포폐암 치료에 대하여 사용을 허가했다. 2004년에는 전이성 유방암 치료에 FDA에서 사용을 허가하였다.[4]
유럽의 라벨은 2008년 EMA와 통일되었다.[26]
2008년 기준 릴리에서 젬시타빈으로 올린 매출은 17억 달러에 이르렀다. 당시 젬시타빈의 미국에서의 특허권은 2013년에, 유럽에서의 특허권은 2009년에 만료될 예정이었다.[27] 첫 번째 복제약은 2009년 유럽에서 만들어졌으며,[7] 미국에서는 특허권에 대한 이의가 제기되어 약물 제조법에 대한 릴리의 특허권이 무효화되었다.[28][29] 복제약 회사들은 미국에서 화학 물질 그 자체에 대한 특허가 만료되자 2010년부터 복제약을 만들어 팔기 시작하였다.[29][8] 중국에서 벌어진 특허권 소송은 헤드라인에 오르기도 하면서 2010년이 되어서 해결되었다.[30]
Remove ads
각주
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads