상위 질문
타임라인
채팅
관점
조합화학
위키백과, 무료 백과사전
Remove ads
조합화학(combinatorial chemistry)은 단일 공정으로 수많은(수십에서 수천 또는 수백만에 이르는) 화합물을 제조할 수 있게 하는 화학 합성 방법으로 구성된다. 이러한 화합물 라이브러리는 혼합물, 개별 화합물의 집합 또는 컴퓨터 소프트웨어로 생성된 화학 구조로 만들 수 있다.[1] 조합화학은 저분자 및 펩타이드 합성에도 사용될 수 있다.
라이브러리의 유용한 구성 요소를 식별할 수 있는 전략도 조합화학의 일부이다. 조합화학에 사용되는 방법은 화학 외 분야에서도 적용된다.
서론
조합화학의 기본 원리는 매우 많은 수의 화합물 화합물 라이브러리를 준비하고 잠재적인 약물 또는 농약으로 유용한 화합물을 식별하는 것이다. 이는 충분한 규모로 출력을 평가할 수 있는 고속대량 스크리닝에 의존한다.[2]
조합화학은 1990년대 이후에야 산업에서 실제로 채택되었지만,[3] 그 뿌리는 1960년대 록펠러 대학교의 연구원이었던 브루스 메리필드가 고체상 합성의 펩타이드 연구를 시작했던 때로 거슬러 올라간다. 조합 방식으로 펩타이드를 합성하면 빠르게 많은 수의 분자를 얻을 수 있다. 예를 들어, 20가지 천연 아미노산을 트라이펩타이드에 사용하면 8,000가지(203)의 가능성이 생긴다. 나중에 저분자에 대한 고체상 방법이 도입되었고, 푸르카는 "분할 및 혼합" 접근법을 고안했다.[2][4]
현대적인 형태의 조합화학은 아마도 제약 산업에서 가장 큰 영향을 미쳤을 것이다.[5] 화합물의 활성 프로필을 최적화하려는 연구원들은 다양한 관련 화합물의 '라이브러리'를 만든다.[6][7] 로봇공학의 발전은 조합 합성의 산업적 접근을 이끌었으며, 기업들이 매년 100,000개 이상의 새롭고 독특한 화합물을 일상적으로 생산할 수 있게 했다.[8]
수많은 구조적 가능성을 다루기 위해 연구원들은 종종 '가상 라이브러리'를 만드는데, 이는 주어진 약물특이분자단과 사용 가능한 모든 반응물의 모든 가능한 구조를 전산으로 열거한 것이다.[9] 이러한 라이브러리는 수천에서 수백만 개의 '가상' 화합물로 구성될 수 있다. 연구원은 다양한 계산 및 기준(참조: 흡분대배, 계산화학, QSAR)에 따라 실제 합성을 위한 '가상 라이브러리'의 하위 집합을 선택한다.
1996년 파크-데이비스 제약 연구소의 과학자 앤서니 차르니크는 화합물 라이브러리 합성 자동화의 첫 번째 사용을 연구하고 보고했다. 미국 화학 학회의 조합화학 저널(Journal of Combinatorial Chemistry)의 창립 편집자로서 그는 화합물 라이브러리 합성에서 표적 분류를 위한 RFID 태그 연구를 이끌기도 했다.[10][11]
Remove ads
폴리머(펩타이드 및 올리고뉴클레오타이드)
요약
관점
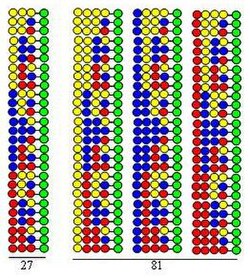
조합 분할-혼합(분할 및 풀) 합성
조합 분할-혼합(분할 및 풀) 합성은[12][13] 로버트 브루스 메리필드가 개발한 고체상 합성을 기반으로 한다.[14] 20개의 아미노산 (또는 다른 종류의 빌딩 블록)을 사용하여 조합 펩타이드 라이브러리를 합성하는 경우, 비드 형태의 고체 지지체는 20개의 동일한 부분으로 나뉜다. 이어서 각 부분에 다른 아미노산을 연결한다. 세 번째 단계는 모든 부분을 혼합하는 것이다. 이 세 단계가 하나의 사이클을 구성한다. 펩타이드 사슬의 길이는 단순히 사이클의 단계를 반복함으로써 연장될 수 있다.

이 절차는 두 사이클 모두에서 동일한 세 가지 아미노산을 빌딩 블록으로 사용하여 다이펩타이드 라이브러리를 합성하는 것으로 설명된다. 이 라이브러리의 각 구성 요소는 다른 순서로 배열된 두 개의 아미노산을 포함한다. 연결에 사용된 아미노산은 그림에서 노란색, 파란색 및 빨간색 원으로 표시된다. 발산 화살표는 고체 지지 수지(녹색 원)를 동일한 부분으로 나누는 것을 보여주고, 수직 화살표는 연결을 의미하며, 수렴 화살표는 지지체 부분을 혼합하고 균질화하는 것을 나타낸다.
그림은 두 가지 합성 사이클에서 9개의 다이펩타이드가 형성됨을 보여준다. 세 번째와 네 번째 사이클에서는 각각 27개의 트라이펩타이드와 81개의 테트라펩타이드가 형성될 것이다.
"분할-혼합 합성"은 몇 가지 뛰어난 특징을 가지고 있다.
- 효율성이 매우 높다. 그림에서 볼 수 있듯이 합성 과정에서 형성되는 펩타이드 수(3, 9, 27, 81)는 실행된 사이클 수에 따라 기하급수적으로 증가한다. 각 합성 사이클에서 20개의 아미노산을 사용하면 형성되는 펩타이드 수는 각각 400, 8,000, 160,000, 3,200,000이다. 이는 펩타이드 수가 실행된 사이클 수에 따라 기하급수적으로 증가함을 의미한다.
- 사이클에서 사용된 아미노산의 조합으로 추론할 수 있는 모든 펩타이드 서열이 이 과정에서 형성된다.
- 지지체를 동일한 샘플로 분할하면 라이브러리 구성 요소가 거의 동일한 몰량으로 형성되도록 보장한다.
- 각 지지체 비드에는 단일 펩타이드만 형성된다. 이는 연결 단계에서 하나의 아미노산만 사용하기 때문이다. 그러나 선택된 비드를 차지하는 펩타이드가 무엇인지는 완전히 알려져 있지 않다.
- 분할-혼합 방법은 빌딩 블록으로부터 단계별 과정으로 준비될 수 있는 유기 또는 다른 종류의 라이브러리 합성에 사용될 수 있다.
1990년에 세 그룹이 생물학적 방법으로 펩타이드 라이브러리를 준비하는 방법을 설명했고[15][16][17] 1년 후 Fodor 등은 작은 유리 슬라이드에 펩타이드 어레이를 합성하는 괄목할 만한 방법을 발표했다.[18]
마리오 가이센(Mario Geysen)과 그의 동료들은 펩타이드 어레이를 준비하기 위한 "병렬 합성" 방법을 개발했다.[19] 그들은 끝에 고체 지지대가 코팅된 플라스틱 막대(핀)에 96개의 펩타이드를 합성했다. 핀은 마이크로타이터 플레이트의 우물에 놓인 시약 용액에 잠겼다. 이 방법은 특히 자동 병렬 합성기를 사용하여 널리 적용된다. 병렬 방법은 실제 조합 방법보다 훨씬 느리지만, 각 핀에 어떤 펩타이드 또는 다른 화합물이 형성되는지 정확히 알 수 있다는 장점이 있다.
분할-혼합과 병렬 합성의 장점을 결합하기 위한 추가 절차가 개발되었다. 두 그룹이 설명한 방법에서는[20][21] 고체 지지체가 투과성 플라스틱 캡슐 안에, 캡슐 안에 형성될 화합물의 코드를 담고 있는 무선 주파수 태그와 함께 봉입되었다. 절차는 분할-혼합 방법과 유사하게 수행되었다. 그러나 분할 단계에서는 캡슐의 무선 주파수 태그에서 읽은 코드에 따라 캡슐이 반응 용기 사이에 분배되었다.
같은 목적으로 Furka 등이 개발한 다른 방법은[22] "스트링 합성"이라고 명명되었다. 이 방법에서는 캡슐에 코드가 없었다. 캡슐은 목걸이의 진주처럼 꿰어져 실에 꿰인 형태로 반응 용기에 놓였다. 캡슐의 정체성과 내용물은 실에 차지하는 위치에 의해 저장된다. 각 연결 단계 후에 캡슐은 특정 규칙에 따라 새로운 실 사이에 재분배된다.
Remove ads
저분자
요약
관점
약물 발견 과정에서 관심 있는 저분자의 합성 및 생물학적 평가는 일반적으로 길고 힘든 과정이었다. 조합화학은 최근 수십 년 동안 잠재적인 저분자 약물 후보를 대량으로 빠르고 효율적으로 합성하는 접근 방식으로 부상했다. 일반적인 합성에서는 합성 계획의 끝에서 단일 표적 분자만 생산되며, 합성의 각 단계에서는 단일 제품만 생산된다. 조합 합성에서는 단일 출발 물질만 사용하는 경우, 동일한 반응 조건에서 대량의 분자 라이브러리를 합성하여 생물학적 활성을 스크리닝할 수 있다. 이 제품 풀은 각각 세 가지 제품을 포함하는 세 개의 동일한 부분으로 나뉘며, 그런 다음 세 개의 개별 풀 각각은 다른 시약 B, C 또는 D 단위와 반응하여 이전 3개에서 9개의 고유한 화합물을 생산한다. 이 과정은 원하는 수의 빌딩 블록이 추가될 때까지 반복되어 많은 화합물을 생성한다. 다단계 합성에 의해 화합물 라이브러리를 합성할 때 효율적인 반응 방법을 사용해야 하며, 각 반응 단계 후에 전통적인 정제 방법을 사용하면 수율과 효율성이 저하될 것이다.
고체상 합성은 합성 화학에서 흔히 사용되는 일반적인 담금 및 정제 단계를 피할 수 있는 잠재적인 해결책을 제공한다. 일반적으로 출발 분자는 고체 지지체(일반적으로 불용성 고분자)에 부착된 다음 추가 반응이 수행되고, 최종 생성물은 정제된 후 고체 지지체에서 분리된다. 관심 있는 분자가 고체 지지체에 부착되어 있으므로 각 반응 후 정제를 단일 여과/세척 단계로 줄일 수 있어 대부분의 합성 화학에서 수반되는 지루한 액체-액체 추출 및 용매 증발 단계를 제거할 수 있다. 또한, 불균일 반응물을 사용함으로써 느린 반응을 완료시키기 위해 과량의 시약을 사용할 수 있어 수율을 더욱 향상시킬 수 있다. 과량의 시약은 크로마토그래피와 같은 추가 정제 단계 없이 단순히 세척하여 제거할 수 있다.

수년에 걸쳐 조합화학에서 고체상 유기 합성의 사용을 개선하기 위해 다양한 방법이 개발되었으며, 여기에는 합성 및 정제의 용이성을 높이는 노력뿐만 아니라 중간 생성물을 특성화하는 비전통적인 방법도 포함된다. 여기에 설명된 대부분의 예는 모든 반응 단계에서 불균일 반응 매체를 사용하지만, Booth와 Hodges는 전통적인 용액상 합성의 정제 단계에서만 고체 지지 시약을 사용하는 초기 사례를 제공한다.[23] 그들의 견해로는 용액상 화학은 분자를 수지에 고정하고 제거하는 데 필요한 부착 및 분리 반응을 피하고, 확립된 용액상 반응의 고체상 유사체를 재현할 필요를 없애는 장점을 제공한다.
합성 말기의 단일 정제 단계는 문제가 되는 불순물의 화학 구조를 알고 있다고 가정할 때 하나 이상의 불순물을 제거할 수 있도록 한다. 고체 지지 시약의 사용은 화합물 합성을 크게 단순화하지만, 많은 조합 합성은 여러 단계를 필요로 하며, 각 단계는 여전히 어떤 형태의 정제를 필요로 한다. Armstrong 등은 다중 성분 응축(MCC)이라는 조합 라이브러리를 생성하는 단일 용기 방법을 설명한다.[24] 이 계획에서는 세 개 이상의 시약이 반응하여 각 시약이 단일 단계에서 최종 생성물에 통합되므로, 많은 정제 단계를 포함하는 다단계 합성이 필요 없다. MCC에서는 각 어레이 합성에서 단일 생성물만 존재하므로, 어떤 화합물이 생물학적으로 활성인지 확인하기 위한 역전개가 필요 없으며, 따라서 화합물의 정체성은 명확하게 알려져야 한다.

또 다른 어레이 합성에서 Still은 분할 합성을 통해 올리고펩타이드의 대규모 라이브러리를 생성했다.[25] 수천 개의 화합물을 만드는 단점은 형성된 화합물의 구조를 결정하기 어렵다는 것이다. 그들의 해결책은 분자 태그를 사용하는 것인데, 미량(1 pmol/비드)의 염료를 비드에 부착하고, 특정 비드의 정체성은 비드에 존재하는 태그를 분석하여 결정할 수 있다. 태그를 부착하는 것이 수용체의 식별을 얼마나 쉽게 만들더라도, 각 화합물의 수용체 결합 능력을 개별적으로 스크리닝하는 것은 불가능할 것이다. 그래서 각 수용체에 염료를 부착하여 기질에 결합하는 수용체만 색상 변화를 생성하도록 했다.
많은 반응을 어레이에서 실행해야 할 경우(Armstrong의 MCC 어레이 중 하나에 설명된 96개의 반응과 같이), 효율성을 향상시키기 위해 합성의 더 지루한 측면 중 일부를 자동화할 수 있다. 이 작업인 "DIVERSOMER법"은 1990년대 초 파크-데이비스에서 최대 40개의 화학 반응을 병렬로 실행하기 위해 개척되었다. 이러한 노력은 조합화학을 위한 최초의 상용 장비(Chemglass가 판매한 Diversomer 합성기)와 화학 실험실 내에서 액체 처리 로봇 공학의 첫 번째 사용으로 이어졌다.[26][27] 이 방법은 수지 로딩 및 세척 사이클뿐만 아니라 반응 사이클 모니터링 및 정제를 자동화하는 장치를 사용하며, 히단토인 및 벤조디아제핀과 같은 다양한 분자 클래스를 합성하는 데 이를 사용하여 8개 또는 40개의 개별 반응을 병렬로 실행함으로써 이들의 방법과 장치의 실현 가능성을 입증한다. 이 연구 및 조합화학 분야의 여러 선구적인 노력은 1999년에 이 분야의 "고전적인" 논문으로 소개되었다.[28]
흔히 값비싼 장비를 사용할 수 없는 경우도 있는데, Schwabacher 등은 라이브러리 구성원의 병렬 합성 및 화합물 전체 라이브러리 평가를 결합하는 간단한 방법을 설명한다.[29] 그들의 방법에서는 다른 영역으로 나뉜 실을 원통 주위에 감싸고, 각 영역에는 단일 종만 있는 다른 시약이 결합된다. 그런 다음 실은 다시 나뉘어 다른 크기의 원통 주위에 감싸지고, 이 과정은 반복된다. 이 방법의 장점은 각 제품의 정체성을 단순히 실을 따라 있는 위치로 알 수 있고, 해당 생물학적 활성은 형광 신호의 푸리에 변환에 의해 식별된다는 것이다.

여기서 설명된 대부분의 합성에서는 출발 시약을 고체 지지체에 부착하고/또는 제거하는 것이 필요하다. 이는 하이드록실 그룹을 생성할 수 있으며, 이는 표적 화합물의 생물학적 활성에 잠재적으로 영향을 미칠 수 있다. Ellman은 다단계 합성 계획에서 고체상 지지체를 사용하여 192개의 개별 1,4-벤조디아제핀 유도체를 얻었는데, 이는 잘 알려진 치료제이다.[30] 잠재적인 하이드록실 그룹 간섭의 가능성을 제거하기 위해, 실릴-아릴 화학을 사용하는 새로운 방법이 분자를 고체 지지체에 연결하는 데 사용되며, 이는 지지체에서 분리될 때 링커의 흔적을 남기지 않는다.

분자를 고체 지지체에 고정할 때, 중간체를 수지에서 분리하지 않고는 서로 분리할 수 없다. 반응 진행 상황을 추적하고 제품 구조를 확인하는 데 사용되는 전통적인 특성화 기술 중 상당수가 용액 기반이므로 다른 기술을 사용해야 한다. 겔상 13C NMR 분광학, MALDI 질량 분석법, 적외선 분광법이 구조 확인 및 고체상 반응 진행 모니터링에 사용되었다.[31] Gordon 등은 이민과 펩티딜 포스폰산을 사용하여 저분자의 조합 라이브러리를 생성하는 몇 가지 사례 연구를 설명한다.[31] 이민 라이브러리를 생성하기 위해 수지에 연결된 아미노산이 알데하이드 존재 하에서 반응한다. 저자들은 빠른 13C 겔상 NMR 분광학과 매직 앵글 스피닝 1H NMR 분광학을 사용하여 반응 진행 상황을 모니터링하고, 트리메틸 오르토포르메이트를 용매로 사용했을 때 대부분의 이민이 실온에서 10분 만에 형성될 수 있음을 보여주었다. 형성된 이민은 4-티아졸리디논, B-락탐, 피롤리딘을 생성하기 위해 유도체화되었다.
고체상 지지체의 사용은 화합물의 대규모 조합 라이브러리 합성을 크게 단순화한다. 이는 출발 물질을 고체 지지체에 고정하고, 충분히 큰 라이브러리가 구축될 때까지 후속 반응을 실행한 후, 생성물을 지지체에서 분리하는 방식으로 이루어진다. 고체상 정제는 표준 액체-액체 추출 정제 기술과 함께 용액상 합성 계획에도 사용될 수 있음이 입증되었다.
Remove ads
역전개 및 스크리닝
요약
관점
조합 라이브러리
조합 라이브러리는 단일 단계별 과정으로 합성되는 저분자 화학 물질의 특별한 다성분 혼합물이다. 이는 개별 화합물 컬렉션과 병렬 합성으로 제조된 화합물 시리즈와는 다르다. 합성에 혼합물이 사용된다는 점이 중요한 특징이다. 혼합물을 사용하면 공정의 효율성이 매우 높아진다. 두 반응물 모두 혼합물일 수 있으며, 이 경우 절차는 더욱 효율적일 것이다. 그러나 실제적인 이유로 두 혼합물 중 하나를 단일 빌딩 블록(BB)으로 대체하는 분할-혼합 방법을 사용하는 것이 좋다. 혼합물은 합성에서 혼합물을 사용하지 않고는 조합 라이브러리가 존재하지 않으며, 공정에서 혼합물이 사용되면 필연적으로 조합 라이브러리가 형성될 정도로 중요하다. 분할-혼합 합성은 일반적으로 고체 지지체를 사용하여 구현되지만, 용액에서도 적용할 수 있다. 구성 요소의 구조를 알 수 없으므로 스크리닝에서 역전개 방법을 사용해야 한다. 조합 라이브러리의 가장 중요한 특징 중 하나는 전체 혼합물을 단일 공정으로 스크리닝할 수 있다는 것이다. 이는 이러한 라이브러리를 제약 연구에 매우 유용하게 만든다. 전체 조합 라이브러리의 부분 라이브러리도 합성할 수 있다. 그중 일부는 역전개에 사용될 수 있다.[32]
고체 지지체에서 분리된 라이브러리의 역전개
조합 라이브러리의 합성된 분자가 고체 지지체에서 분리되면 가용성 혼합물이 형성된다. 이러한 용액에는 수백만 개의 다른 화합물이 발견될 수 있다. 이 합성 방법이 개발되었을 때, 분자를 식별하고 유용한 특성을 가진 분자를 찾는 것이 불가능해 보였다. 그러나 문제 해결을 위해 유용한 구성 요소를 식별하기 위한 전략이 개발되었다. 이러한 모든 전략은 부분 라이브러리의 합성 및 테스트를 기반으로 한다. 초기 반복 전략은 Furka가 1982년에 고안했다.[4] 이 방법은 나중에 Erb 등이 "재귀적 역전개(Recursive deconvolution)"라는 이름으로 독립적으로 발표했다.[33]

재귀적 역전개
이 방법은 그림으로 이해할 수 있다. 27개의 펩타이드 라이브러리가 세 가지 아미노산으로 합성된다. 첫 번째 (A) 및 두 번째 (B) 사이클 후에 샘플을 혼합하기 전에 따로 보관했다. 세 번째 사이클 (C)의 생성물은 혼합하기 전에 분리한 다음 활성 테스트를 거친다. + 부호로 표시된 그룹이 활성이라고 가정해 보자. 모든 구성원은 마지막 연결 위치(CP)에 빨간색 아미노산을 가지고 있다. 결과적으로 활성 구성원도 마지막 CP에 빨간색 아미노산을 가지고 있다. 그런 다음 두 번째 사이클 (B) 후에 따로 보관했던 세 가지 샘플에 빨간색 아미노산을 연결하여 샘플 D를 얻는다. 분리 후 세 가지 E 샘플이 형성된다. 테스트 후 +로 표시된 샘플이 활성인 것으로 나타나면 활성 구성 요소의 두 번째 CP에 파란색 아미노산이 차지하고 있음을 보여준다. 그런 다음 세 가지 A 샘플에 먼저 파란색, 그 다음 빨간색 아미노산을 연결(F)한 다음 분리 후 다시 테스트(G)한다. + 구성 요소가 활성으로 판명되면 활성 구성 요소의 서열이 결정되고 H에 표시된다.
위치 스캐닝
위치 스캐닝은 Furka 등과[34] Pinilla 등이[35] 독립적으로 도입했다. 이 방법은 특정 서열 위치가 동일한 아미노산으로 채워진 일련의 하위 라이브러리의 합성 및 테스트를 기반으로 한다. 그림은 세 가지 아미노산으로 만든 완전한 펩타이드 삼량체 라이브러리(A)의 9개 하위 라이브러리(B1-D3)를 보여준다. 하위 라이브러리에는 모든 구성 요소에서 동일한 아미노산이 차지하는 위치가 있다. 하위 라이브러리 합성 시 지지체는 분할되지 않으며, 전체 샘플에 하나의 아미노산만 연결된다. 결과적으로 하나의 위치는 모든 구성 요소에서 실제로 동일한 아미노산이 차지한다. 예를 들어, B2 하위 라이브러리에서는 9개 구성 요소 모두에서 위치 2가 "노란색" 아미노산으로 채워져 있다. 스크리닝 테스트에서 이 하위 라이브러리가 양성 반응을 보이면 활성 펩타이드에서 위치 2도 "노란색" 아미노산으로 채워져 있음을 의미한다. 아미노산 서열은 9개(또는 때로는 그 이하)의 모든 하위 라이브러리를 테스트하여 결정할 수 있다.


생략 라이브러리
생략 라이브러리에서[36][37] 특정 아미노산은 혼합물의 모든 펩타이드에서 누락된다. 그림은 완전한 라이브러리와 세 가지 생략 라이브러리를 보여준다. 상단에는 생략된 아미노산이 표시되어 있다. 생략 라이브러리가 음성 테스트를 보이면 생략된 아미노산이 활성 구성 요소에 존재한다.
고정된 조합 라이브러리의 역전개
펩타이드가 고체 지지체에서 분리되지 않으면, 각 비드가 단일 펩타이드를 포함하는 비드 혼합물을 다루게 된다. Smith와 그의 동료들은[38] 이전에 펩타이드도 고정된 형태로 테스트될 수 있음을 보여주었다. 이 접근법은 펩타이드 라이브러리 스크리닝에도 사용되었다. 고정된 펩타이드 라이브러리는 용해된 표적 단백질로 테스트되었다. 단백질이 부착된 비드를 골라내어 비드에서 단백질을 제거한 다음, 고정된 펩타이드를 시퀀싱하여 식별했다. Taylor와 Morken은 다소 다른 접근법을 따랐다.[39] 그들은 비펩타이드 고정 라이브러리에서 촉매를 식별하기 위해 적외선 열화상을 사용했다. 이 방법은 고정된 라이브러리가 기질 용액에 잠겼을 때 촉매를 포함하는 비드에서 발생하는 열을 기반으로 한다. 비드를 적외선 현미경으로 검사하면 촉매를 포함하는 비드가 밝은 점으로 나타나서 골라낼 수 있다.
암호화된 조합 라이브러리
비펩타이드 유기 라이브러리를 다룰 때는 펩타이드 라이브러리의 경우처럼 비드 내용물의 정체를 결정하는 것이 간단하지 않다. 이 어려움을 극복하기 위해 라이브러리 합성 과정과 병행하여 비드에 형성된 화합물의 구조를 암호화하는 분자를 비드에 부착하는 방법이 개발되었다. Ohlmeyer와 그의 동료들은 이진 암호화 방법을 발표했다.[40] 그들은 18가지 태깅 분자 혼합물을 사용했는데, 이 분자들은 비드에서 분리된 후 전자 포획 가스 크로마토그래피로 식별될 수 있었다. Sarkar 등은 질량으로 암호화된 OBOC 라이브러리를 구축하는 데 사용될 수 있는 펜텐산 아미드(COPA)의 카이랄 올리고머를 설명했다.[41] Kerr 등은 혁신적인 인코딩 방법을 도입했다.[42] 직교 보호된 제거 가능한 이기능성 링커가 비드에 부착되었다. 링커의 한쪽 끝은 라이브러리의 비천연 빌딩 블록을 부착하는 데 사용되었고, 다른 쪽 끝에는 인코딩 아미노산 삼량체가 연결되었다. 빌딩 블록은 비천연 아미노산이었고, 그들의 인코딩 아미노산 삼량체 시리즈는 에드만 분해로 결정될 수 있었다. 이러한 종류의 인코딩의 중요한 측면은 라이브러리 구성원과 그에 부착된 인코딩 태그를 비드에서 분리하여 가용성 라이브러리를 형성할 수 있다는 것이었다. Nikolaiev 등도 펩타이드로 인코딩하는 데 동일한 접근법을 사용했다.[43] 1992년에 Brenner와 Lerner는 고체 지지체의 비드를 인코딩하기 위해 DNA 서열을 도입했는데, 이는 가장 성공적인 인코딩 방법으로 입증되었다.[44] Nielsen, Brenner, Janda도 DNA 인코딩을 구현하기 위해 Kerr 접근법을 사용했다.[45] 최근에는 DNA 시퀀싱 분야에서 중요한 발전이 있었다. 차세대 기술은 대량의 샘플을 병렬로 시퀀싱할 수 있게 하여 DNA 암호화 라이브러리의 스크리닝에 매우 중요하다. DNA 암호화의 성공에 기여한 또 다른 혁신이 있었다. 2000년에 Halpin과 Harbury는 DNA 암호화 조합 라이브러리의 분할-혼합 합성에서 고체 지지체를 생략하고 이를 암호화 DNA 올리고머로 대체했다. 고체상 분할 및 풀 합성에서 라이브러리 구성 요소의 수는 지지체 비드의 수를 초과할 수 없다. 저자들의 새로운 접근법으로 이 제약이 제거되었고, 실질적으로 무제한의 새로운 화합물을 준비할 수 있게 되었다.[46] 예를 들어, 덴마크 회사 Nuevolution은 40조 개의 구성 요소를 포함하는 DNA 암호화 라이브러리를 합성했다![47] DNA 암호화 라이브러리는 가용성이어서 스크리닝에서 효율적인 친화성 결합을 적용할 수 있다. 일부 저자는 DNA 암호화 조합 라이브러리의 약어로 DEL을 적용하고 다른 저자는 DECL을 사용한다. 후자는 이 이름에서 이러한 라이브러리의 조합적 특성이 명확하게 표현되므로 더 나은 것으로 보인다. 여러 유형의 DNA 암호화 조합 라이브러리가 현재 천년기의 첫 10년 동안 도입되고 설명되었다. 이러한 라이브러리는 약물 연구에 매우 성공적으로 적용되고 있다.
- Gartner 등이 2001년에 설명한 조합 라이브러리의 DNA 주형 합성[48]
- Mlecco 등이 2004년에 발명한 이중 약물특이분자단 DNA 암호화 조합 라이브러리[49]
- Halbury Halpin과 Harbury가 2004년에 발표한 서열 암호화 라우팅[50]
- Manocci 등이 2008년에 도입한 단일 약물특이분자단 DNA 암호화 조합 라이브러리[51]
- Hansen 등이 2009년에 발표한 요크토리터 규모 반응기를 사용하여 형성된 DNA 암호화 조합 라이브러리[52]
합성 및 응용에 대한 자세한 내용은 DNA 인코딩 화학 라이브러리 페이지에서 찾을 수 있다. DNA 암호화 가용성 조합 라이브러리에도 단점이 있다. 우선, 고체 지지체 사용에서 오는 장점이 완전히 사라진다. 또한, DNA 암호화 사슬의 다이온성 특성은 합성에서 비수성 용매의 유용성을 제한한다. 이러한 이유로 많은 연구실에서 DECL 합성에 사용할 수 있는 DNA 호환 반응을 개발하기로 선택한다. 이미 많은 수의 사용 가능한 반응이 설명되어 있다.[53][54][55]
Remove ads
재료과학
재료과학은 조합화학 기술을 새로운 재료 발견에 적용했다. 이 연구는 90년대 중반 P.G. 슐츠 등에 의해 실리콘 기판에 원소를 공증착하여 얻은 발광 재료의 맥락에서 개척되었다.[56] 그의 연구는 1970년 J. J. Hanak에 의해 선행되었지만[57] 당시에는 이 방법이 확산될 컴퓨터 및 로봇 도구가 없었다. 여러 학술 그룹[58][59][60][61] 뿐만 아니라 대규모 연구 개발 프로그램을 가진 회사들(사이믹스 테크놀로지스, GE, 다우 케미칼 등)에 의해 연구가 계속되었다. 이 기술은 촉매 반응,[62] 코팅,[63] 전자 장치[64] 및 기타 여러 분야에서 광범위하게 사용되었다.[65] 생성되는 방대한 양의 데이터를 처리, 관리 및 저장하는 데 적절한 정보학 도구의 적용이 중요하다.[66] 조합 방법을 사용하여 다룰 수 있는 광대한 실험 공간을 효율적으로 다루기 위해 새로운 유형의 실험계획법도 개발되었다.[67]
Remove ads
다양성 지향 라이브러리
조합화학은 20년 이상 초기 약물 발견의 필수적인 부분이었지만, 지금까지 FDA에 의해 임상 사용이 승인된 de novo 조합화학 합성 화합물은 단 하나뿐이다(소라페닙, 진행성 신장암에 사용되는 다중 키나아제 억제제).[68] 이 접근법의 낮은 성공률에 대한 분석은 조합화학 제품이 다루는 다소 제한적인 화학 공간과 관련이 있을 수 있다고 제안되었다.[69] 조합화학 라이브러리의 화합물 특성을 승인된 약물 및 천연물과 비교했을 때, Feher와 Schmidt는[69] 조합화학 라이브러리가 특히 카이랄성과 구조적 강직성 부족으로 어려움을 겪는다는 점을 지적했는데, 이 두 가지 모두 약물과 유사한 특성으로 널리 간주된다. 비록 천연물 약물 발견이 최근 제약 산업에서 가장 유행하는 경향은 아니었지만,[2] 새로운 화학 물질의 상당 부분은 여전히 천연 유래 화합물이며,[70][71][72][73] 따라서 스크리닝 라이브러리의 화학적 다양성을 강화함으로써 조합화학의 효율성을 향상시킬 수 있다고 제안되었다.[74] 카이랄성과 강직성은 승인된 약물과 천연물을 조합화학 라이브러리의 화합물과 구별하는 가장 중요한 두 가지 특징이므로, 이들은 소위 다양성 지향 라이브러리, 즉 방대한 수의 화합물 대신 화학 공간의 범위를 목표로 하는 화합물 컬렉션에서 강조되는 두 가지 문제이다.[75][76][77][78][79][80]
Remove ads
특허 분류 하위 분류
2006년 1월 1일 발효된 국제특허분류 (IPC) 제8판에서는 조합화학 분야의 발명과 관련된 특허 출원 및 특허를 위한 특별 하위 분류인 "C40B"가 생성되었다.
같이 보기
각주
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads