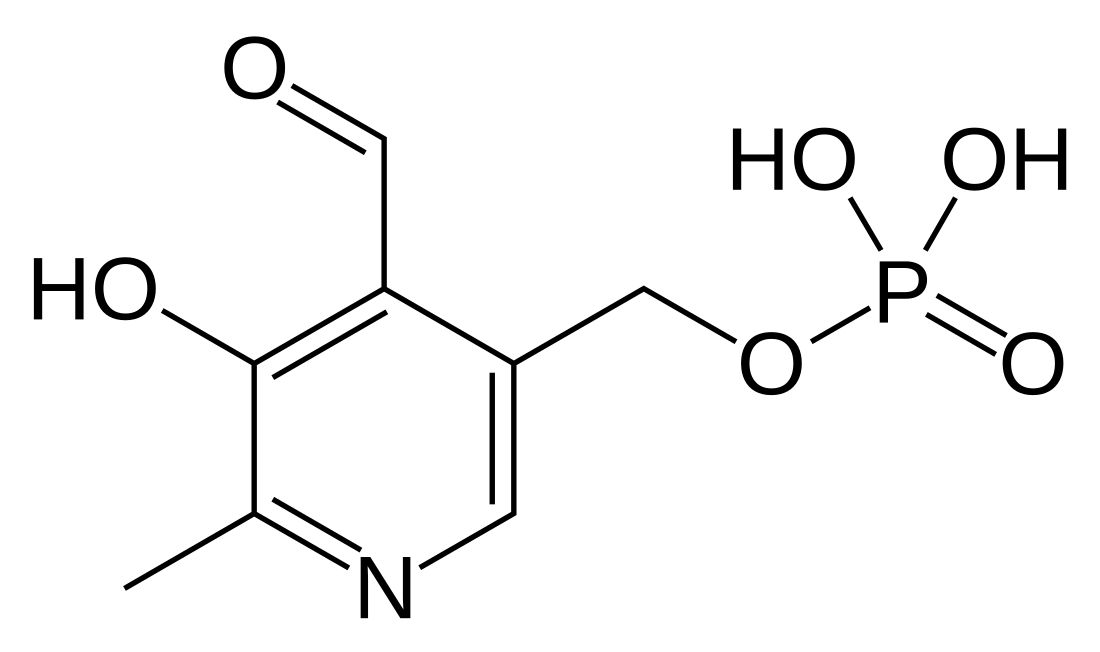
Piridoksal fosfat
From Wikipedia, the free encyclopedia
Remove ads
Piridoksal fosfat (PLP, piridoksal 5'-fosfat, P5P), satu bentuk aktif vitamin B6, ialah koenzim dalam pelbagai tindak balas enzim. Kesatuan Biokimia dan Biologi Molekul Antarabangsa telah mengkatalogkan lebih 140 aktiviti yang bergantungan PLP, bersamaan dengan ~4% daripada semua aktiviti yang dikelaskan.[5] Fleksibiliti PLP timbul daripada keupayaannya untuk mengikat substrat secara kovalen, dan kemudian bertindak sebagai pemangkin elektrofilik, dengan itu menstabilkan pelbagai jenis perantaraan tindak balas karbanion.
Remove ads
Peranan sebagai koenzim
PLP bertindak sebagai koenzim dalam semua tindak balas transaminasi, dan dalam tindak balas penyahkarboksilan, deaminasi, dan peraseman asid amino tertentu.[6] Kumpulan aldehid PLP membentuk hubungan bes Schiff (aldimina dalaman) dengan kumpulan ε-amino kumpulan lisina khusus enzim aminotransferase. Kumpulan α-amino substrat asid amino menggantikan kumpulan ε-amino bagi sisa lisina tapak aktif dalam proses yang dikenali sebagai pentransaldiminaan. Aldimina luaran yang terhasil boleh kehilangan proton, karbon dioksida atau rantai sampingan asid amino untuk menjadi perantaraan quinonoid yang seterusnya boleh bertindak sebagai nukleofil dalam beberapa laluan tindak balas.
Dalam transaminasi, selepas penyahprotonan, perantaraan kuinonoid menerima proton pada kedudukan yang berbeza untuk menjadi ketimina. Ketimina yang terhasil dihidrolisiskan supaya kumpulan amino kekal di kompleks.[7] Selain itu, PLP digunakan oleh aminotransferase yang bertindak ke atas gula luar biasa seperti perosamina dan desosamina.[8] Dalam tindak balas ini, PLP bertindak balas dengan glutamat, yang memindahkan kumpulan alfa-aminonya kepada PLP untuk menghasilkan piridoksamina fosfat (PMP). PMP kemudian memindahkan nitrogennya kepada gula lalu membentuk gula amino.
PLP juga terlibat dalam pelbagai tindak balas penghapusan beta seperti tindak balas yang dijalankan oleh serina dehidratase dan GDP-4-keto-6-deoksimanosa-3-dehidratase (ColD).[8]
Ia juga aktif dalam tindak balas pemeluwapan dalam sintesis hem.
PLP memainkan peranan dalam penukaran levodopa kepada dopamina, memudahkan penukaran glutamat neurotransmiter pengujaan kepada neurotransmitter yang menghalang GABA, dan membolehkan SAM didekarboksilasi untuk membentuk propilamina, molekul pelopor poliamina.
Remove ads
Peranan dalam tubuh manusia
Piridoksal fosfat mempunyai banyak peranan dalam tubuh manusia. Beberapa contoh di bawah:
- Metabolisme dan biosintesis serotonin . Piridoksal fosfat ialah kofaktor dekarboksilase asid L-amino aromatik. Ini membolehkan penukaran 5-hidroksitriptofan (5-HTP) kepada serotonin (5-HT). Tindak balas ini berlaku dalam neuron serotonergik.
- Metabolisme dan biosintesis histamin. Piridoksal fosfat ialah kofaktor L-histidina dekarboksilase. Ini membolehkan penukaran histidina kepada histamin. Tindak balas ini berlaku dalam radas Golgi dalam sel masta dan basofil. Seterusnya, histamin disimpan dalam butiran sel masta sebagai kompleks dengan sisa asid heparin proteoglikan manakala dalam basofil sebagai kompleks dengan kondroitin sulfat.
- Metabolisme dan biosintesis GABA (asid γ-aminobutirik). Piridoksal fosfat ialah kofaktor asid glutamat dekarboksilase (GAD). Ini membolehkan penukaran glutamat kepada GABA. Tindak balas berlaku dalam sitoplasma penamatan neuron GABA-ergik, oleh itu kekurangan vitamin B6 boleh menyebabkan sawan epilepsi pada kanak-kanak. Piridoksal fosfat juga mengambil bahagian dalam deaminasi oksidatif GABA, di mana ia merupakan kofaktor GABA aminotransferase.
- Metabolisme ornitina. Piridoksal fosfat ialah kofaktor ornitina karboksilase.
- Transaminasi. Piridoksal fosfat mengambil bahagian dalam penguraian dan sintesis asid amino, lemak, dan karbohidrat, dan dalam biosintesis hormon, neurotransmitter, dan hem.[9][10]
Remove ads
Contoh bukan klasik PLP
PLP juga terdapat pada glikogen fosforilase dalam hati, di mana ia digunakan untuk memecahkan glikogen dalam glikogenolisis apabila glukagon atau epinefrina memberi isyarat untuk berbuat demikian. Walau bagaimanapun, enzim ini tidak mengeksploitasi kumpulan aldehid reaktif, sebaliknya menggunakan kumpulan fosfat pada PLP untuk melakukan tindak balasnya.
Walaupun sebahagian besar enzim bergantungan PLP membentuk aldimina dalaman dengan PLP melalui residu lisin tapak aktif, beberapa enzim yang bergantung kepada PLP tidak mempunyai lisina ini, tetapi sebaliknya mempunyai histidina di tapak aktif. Dalam kes sedemikian, histidina tidak boleh membentuk aldimina dalaman, dan, oleh itu, faktor bersama tidak terikat secara kovalen kepada enzim. CoID ialah contoh enzim sedemikian.[11] Serina hidroksimetiltransferase 2 manusia mengawal tindak balas pemindahan satu karbon yang diperlukan bagi metabolisme asid amino dan nukleotida, dan wujud dalam bentuk dimer dan tetramer. Varian SHMT2 dimer ialah perencat kuat kompleks enzim deubikuitilase BRISC yang mengawal isyarat sel berasaskan imun. Kajian terkini menunjukkan bahawa pentetrameran SJMT2 berlaku disebabkan oleh PLP. Ini menghalang interaksi dengan kompleks deubikutilase, dan berpotensi menghubungkan tahap vitamin B6 dan metabolisme kepada keradangan.[12]
Mekanisme pemangkin
Enzim bergantungan PLP memangkinkan pelbagai tindak balas. Walaupun skop tindak balas pemangkin PLP nampaknya sangat besar, prinsip bersamanya ialah pembentukan aldimina asal lisina dalaman. Sebaik sahaja substrat amino berinteraksi dengan tapak aktif, bes Schiff baharu dijana, biasanya dirujuk sebagai aldimina luaran. Selepas langkah ini, laluan untuk setiap tindak balas yang dimangkinkan PLP berbeza.[13]

Remove ads
Kekhususan
Kekhususan dihadkan oleh pemutusan ikatan berserenjang dengan cincin piridina daripada empat ikatan alfa-karbon dalam keadaan aldimina asid amino (hipotesis stereoelektronik Dunathan).[14][15] Akibatnya, kekhususan ditentukan oleh bagaimana enzim mengikat substratnya. Peranan tambahan dalam kekhususan dimainkan oleh kemudahan pemprotonan nitrogen cincin piridina.[16]
Enzim PLP
PLP dikekalkan di tapak aktif bukan sahaja kerana lisina, tetapi juga menerusi interaksi kumpulan fosfat dan poket pengikat fosfat dan dalam tahap yang lebih rendah, susunan asas cincin piridina dengan sisa aromatik yang tergantung, umumnya tirosina (yang juga boleh mengambil bahagian dalam pemangkinan asid-bes). Walaupun keperluan terhad sesebuah poket pengikat PLP, enzim PLP tergolong dalam lima keluarga yang berbeza sahaja. Keluarga ini tidak berkait rapat dengan jenis tindak balas tertentu. Lima keluarga dikelaskan berdasarkan jenis lipatan dengan angka Rom.[14]
- Jenis Lipat I — keluarga aspartat aminotransferase
- Jenis Lipat II — keluarga triptofan sintase
- Jenis Lipat III — keluarga alanina rasemase (balang TIM)
- Jenis Lipat IV — keluarga aminotransferase asid D-amino
- Jenis Lipat V — keluarga glikogen fosforilase
Remove ads
Biosintesis
Daripada vitamer
Haiwan adalah auksotrof untuk kofaktor ini, dan memerlukannya atau perantaraannya untuk ditambah, oleh itu klasifikasinya sebagai vitamin B6, tidak seperti MoCo atau CoQ10 sebagai contoh. PLP disintesis daripada pyridoxal oleh enzim piridoksal kinase, memerlukan satu molekul ATP. PLP dimetabolismekan dalam hati.
Prototrofi
Dua laluan semula jadi untuk PLP diketahui pada masa ini: satu memerlukan deoxyxylulose 5-phosphate (DXP), manakala satu lagi tidak, oleh itu ia dikenali sebagai DXP-dependent dan DXP-independent. Laluan ini telah dikaji secara meluas dalam Escherichia coli dan Bacillus subtilis, masing-masing. Walaupun terdapat perbezaan dalam sebatian permulaan dan bilangan langkah yang berbeza yang diperlukan, kedua-dua laluan mempunyai banyak persamaan.[17]
Biosintesis bergantungan DXP
Laluan biosintetik yang bergantungan DXP memerlukan beberapa langkah dan penumpuan dua cabang, satu menghasilkan fosfat 3-hidroksi-1-aminoaseton daripada eritrosa 4-fosfat, manakala satu lagi (enzim tunggal) menghasilkan deoksilulosa 5-fosfat (DXP) daripada gliseraldehid 3-fosfat (GAP) dan piruvat. Hasil pemeluwapan 3-hidroksi-1-aminoaseton fosfat dan deoksilulosa 5-fosfat ialah piridoksina 5'-fosfat. Pemeluwapan dimangkinkan oleh PNP sintase, dikodkan oleh pdxJ, yang menghasilkan PNP (piridoksina 5' fosfat).[18] Enzim terakhir ialah PNP oksidase (pdxH) yang memangkinkan pengoksidaan kumpulan hidroksil 4' kepada aldehid dengan dioksigen lalu menghasilkan hidrogen peroksida.
Cawangan pertama dimangkinkan dalam E. coli oleh enzim yang dikodkan oleh epd, pdxB, serC dan pdxA. Ini berkongsi persamaan mekanisme dan homologi dengan tiga enzim dalam biosintesis serina (serA (homolog pdxB), serC, serB—walau bagaimanapun, epd ialah homolog gap), yang menunjuk ke arah asal evolusi bersama kedua-dua laluan.[19] Dalam beberapa spesies, terdapat dua homolog gen E. coli serC, umumnya satu dalam operon ser (serC), dan satu lagi dalam operon pdx, dalam hal ini ia dipanggil pdxF.

"Laluan kebetulan" ditemui dalam pustaka ekspresi berlebihan yang boleh menyekat auksotrof disebabkan oleh pemadaman pdxB (pengekodan eritronat 4-fosfat dehidrogenase) dalam E. coli. "Laluan kebetulan" ini adalah sangat tidak cekap, tetapi mungkin disebabkan oleh aktiviti rambang pelbagai enzim. Ia bermula dengan 3-fosfohidroksipiruvat (hasil enzim yang dikodkan serA dalam biosintesis serina), dan tidak memerlukan eritronat 4-fosfat. 3PHP telah dinyahfosforilkan, menghasilkan perantaraan tidak stabil yang terdekarboksilat secara spontan (oleh itu, kehadiran fosfat dalam laluan biosintetik serina) kepada glikaldehid. Glikaldehid telah dipeluwapkan dengan glisina, dan produk terfosforil ialah 4-fosfohidroksitreonina (4PHT), subkeadan kanonik untuk 4-PHT dehidrogenase (pdxA).[20]
Biosintesis bebas DXP
Laluan biosintetik PLP bebas DXP terdiri daripada langkah yang dimangkin oleh PLP sintase, enzim yang terdiri daripada dua subunit. PdxS memangkinkan pemeluwapan ribulosa 5-fosfat, gliseraldehid 3-fosfat dan ammonia, molekul terakhir dihasilkan oleh PdxT yang memangkinkan pengeluaran ammonia daripada glutamina. PdxS ialah balang (β/α)8 (juga dikenali sebagai balang TIM) yang membentuk dodekamer.[21]
Sintesis abiotik
Penggunaan meluas PLP dalam metabolisme pusat, terutamanya dalam biosintesis asid amino, dan aktivitinya tanpa kehadiran enzim, mencadangkan PLP mungkin merupakan sebatian "prabiotik", yakni sebelum asal usul kehidupan organik (jangan dikelirukan dengan sebatian prebiotik, bahan yang berfungsi sebagai sumber makanan bakteria bermanfaat).[22] Malah, pemanasan NH3 dan glikoaldehid membentuk pelbagai sebatian piridina secara spontan termasuk piridoksal.[22] Di bawah keadaan tertentu, PLP terbentuk daripada sianoasetilena, diasetilena, karbon monoksida, hidrogen, air dan asid fosforik.[23]
Remove ads
Perencat
Beberapa perencat enzim PLP diketahui.
Satu jenis perencat membentuk elektrofil dengan PLP, menyebabkan ia bertindak balas secara tak berbalik dengan lisina tapak aktif. Sebatian asetilena (cth., propargilglisina) dan sebatian vinil (cth., vinilglisina) ialah contoh perencat sedemikian. Jenis perencat yang berbeza menyahaktifkan PLP, dan seperti itu, merupakan analog substrat α-metil dan amino-oksi (cth., α-metilglutamat). Perencat lain mempunyai kumpulan keluar yang baik yang menyerang PLP secara nukleofilik. Ini ialah kloroalanina yang menghalang sejumlah besar enzim.[14]
Contoh perencat:
- Levotiroksina: Dalam tikus diberi dengan berian 10 µg D, L-tiroksina setiap hari selama 15 hari, aktiviti desulfhidrase sisteina hati hilang, dan aktiviti serina dan treonina dehidrase dan alanina glutamat transaminase berkurangan kira-kira 40%. Pemberian piridoksal 5-fosfat secara in vivo atau penambahan koenzim secara in vitro kepada penyediaan hati mengembalikan aktiviti penuh kepada semua enzim ini, dan sedikit perencatan in vitro dengan kehadiran 10−5 M tiroksina juga diterbalikkan oleh piridoksal 5-fosfat.[24][25]
- Bentuk piridoksina tidak aktif secara persaingan menghalang piridoksal-5'-fosfat aktif. Akibatnya, gejala suplemen vitamin B6 dalam bentuk piridoksina boleh meniru gejala kekurangan vitamin B6; kesan yang mungkin boleh dielakkan dengan menambah P5P sebaliknya.[26]
- AlaP (alanina fosfonat) menghalang alanina rasemase, tetapi kekurangan kekhususannya telah mendorong reka bentuk perencat ALR selanjutnya.[27]
- Gabakulina dan vigabatrin menghalang GABA aminotransferase
- Kanalina dan 5-fluorometilornitina menghalang ornitina aminotransferase
- Amino-oksi SAM menghalang sintase ACC
Remove ads
Evolusi
Enzim bergantungan PDP mempunyai pelbagai asal usul evolusi. Enzim B6 keseluruhannya berpecah kepada empat garis evolusi bebas: keluarga α (iaitu aspartat aminotransferase), keluarga β (serina dehidratase), keluarga D-alanina aminotransferase dan keluarga alanina rasemase. Satu contoh persamaan evolusi dalam keluarga beta dapat dilihat dalam mekanisme. Enzim β kesemuanya ialah semua liase, dan memangkinkan tindak balas di mana Cα dan Cβ mengambil bahagian. Secara keseluruhan, dalam enzim bergantungan PLP, PLP dalam setiap kes dilekatkan secara kovalen melalui ikatan imina kepada kumpulan amino dalam tapak aktif.[28]
Rujukan
Pautan luar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads