Top Qs
Tijdlijn
Chat
Perspectief
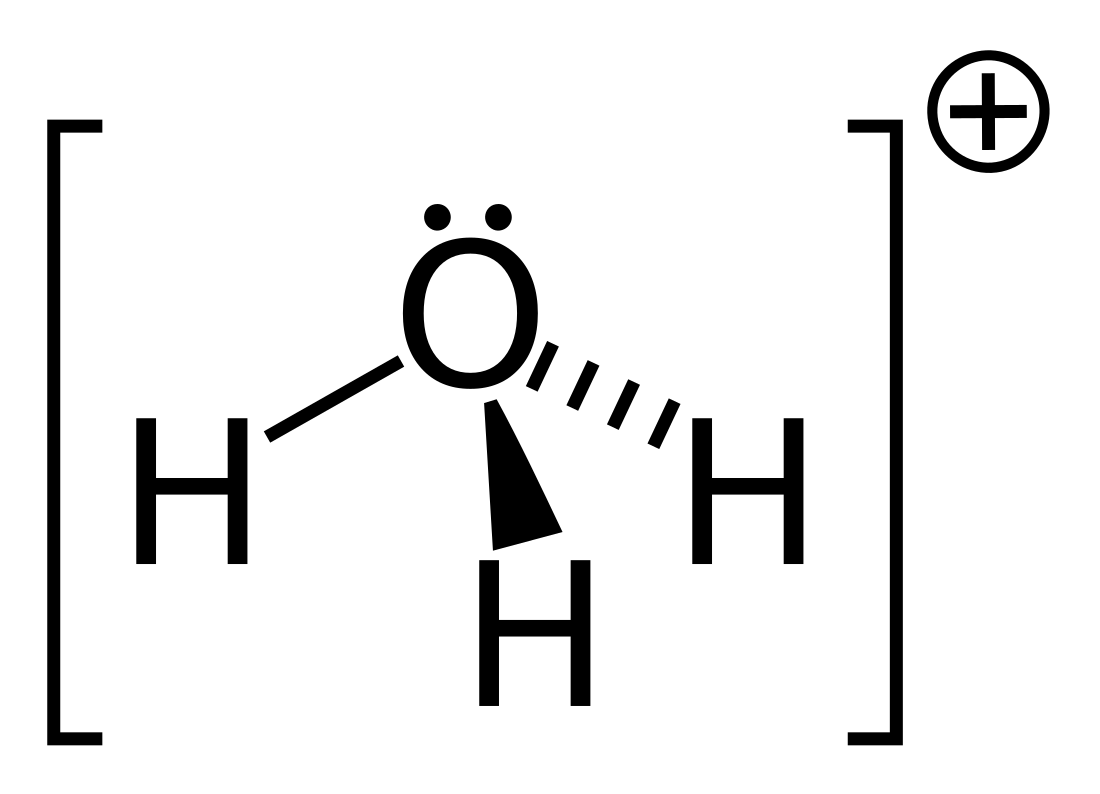
Hydroxonium
H₃O⁺ kation geproduceerd door protonering van water Van Wikipedia, de vrije encyclopedie
Remove ads
Het oxoniumion (IUPAC-naam), ook bekend als hydroxonium- of hydroniumion, is een ion met de formule H3O+. Het is een positief geladen ion (kation) dat gevormd wordt wanneer water (H2O) een waterstofion (H+) opneemt. Het oxoniumion heeft een pKa-waarde (zuurconstante) van 0. Het is het sterkste zuur dat opgelost in water stabiel is. Een nog sterker zuur, zoals zoutzuur (HCl), zal een proton afgeven aan water, dat zo in een oxoniumion omgezet wordt. De pH van een waterige oplossing wordt uitsluitend bepaald door de H3O+-concentratie (of correcter: de activiteit van de oxoniumionen) in de oplossing.
Remove ads
Ionisatie van water
Samenvatten
Perspectief
Water ondervindt ook in pure toestand een kleine mate van ionisatie. Dit gebeurt wanneer een watermolecuul een proton afstaat aan een ander watermolecuul. Dit wordt de eigendissociatie of autoprotolyse van water genoemd, en kan worden gezien als een evenwichtsreactie:
Het oxoniumion is daarmee volgens de theorie van Johannes Nicolaus Brønsted het geconjugeerde zuur van water:
De mate van ionisatie is echter heel klein: de K-waarde voor de eigendissociatie van water is 10-14. Dit getal wordt wel de waterconstante (Kw) genoemd.
Remove ads
Deeltjesmodel voor zure oplossingen
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads