Top Qs
Tijdlijn
Chat
Perspectief
IUPAC-nomenclatuur
Van Wikipedia, de vrije encyclopedie
Remove ads
De IUPAC-nomenclatuur is een systematische manier om elementen en chemische verbindingen van een naam te voorzien. De regels voor deze systematische naamgeving worden opgesteld door de International Union of Pure and Applied Chemistry (IUPAC). Vooral in de organische chemie kent het systeem veelvuldig gebruik, maar er zijn ook naamgevingsregels voor de anorganische chemie en polymeerchemie.
In de IUPAC-nomenclatuur wordt onderscheid gemaakt tussen elementen, organische stoffen (zoals koolwaterstoffen) en anorganische stoffen (zoals zouten). Binnen de IUPAC-nomenclatuur zijn er overkoepelde regels, maar ieder groep van stoffen kent ook eigen regels.
Remove ads
Algemene regels
Samenvatten
Perspectief
Elementnamen
Wanneer een nieuw element is gesynthetiseerd, beslist IUPAC over de naam en het symbool ervan. De lijst van chemische elementen wordt zo langzaam uitgebreid. Theoretische elementen of elementen waarvan het bestaan nog onvoldoende empirisch aangetoond is, krijgen een voorlopige systematische naam met bijhorend symbool op basis van de cijfers van het atoomnummer. Bijv 122Ubb: unbibium.
Telwoorden
De IUPAC-naamgeving maakt in alle groepen van stoffen gebruik van telwoorden (ook wel: prefix). Met deze telwoorden worden aantallen atomen of atoomgroepen binnen een molecuul aangegeven. De telwoorden kennen hun oorsprong in het Grieks of Latijn. Een aantal van deze telwoorden zijn hieronder weergegeven.
De laatste klinker van het telwoord wordt niet weggelaten wanneer er een andere klinker volgt. Bijv. difosforpentaoxide en niet difosforpentoxide. De enige uitzondering hierop is het gebruik van monoxide, dat toegestaan is naast mono-oxide.
De complexe telwoorden (bis, tris, ...) worden gebruikt wanneer een groep die reeds een telwoord (di, tri, ...) in de naam heeft meermaals voorkomt, en om ambiguïteiten te vermijden.
Aaneenschrijven en koppeltekens
De IUPAC-regels worden enkel in het Engels uitgegeven, en in elk taalgebied moeten deze regels aangepast worden naar de lokale taal. De Nederlandstalige namen van chemische verbindingen moeten voldoen aan de algemene spellingsregels van de Nederlandse taal. In het bijzonder moeten alle samenstellingen aaneengeschreven worden. Zo spreekt men van waterstofchloride (Engels: hydrogen chloride). Men mag bij samenstellingen voor de leesbaarheid ook extra koppeltekens toevoegen, maar dit wordt zelden gedaan in chemische context.
Alle klinkerbotsingen die daarbij optreden, moeten vermeden worden door een correct gebruik van koppeltekens of trema's. Bijv. dioxido-uraan(2+) en niet dioxidouraan(2+). In het geval van klinkerbotsingen met Griekse en Latijnse voorvoegsels gebruikt men een koppelteken. Correcte spelling is bijvoorbeeld di-ijzertrioxide, tri-ethylamine en di-jood. Het weglaten van deze koppeltekens is niet correct.
De spelling triëthylamine is verouderd (vóór 1996). Trema's worden wel gebruikt bij ongelede woorden en afleidingen, bijv. benzoëzuur, cyclopentadiënyl en butadiënen.
Getallen in de naam worden steeds gescheiden van de rest van een naam door een koppelteken. Bijv. propaan-2-on.
Bepalen van de stamnaam en plaatsnummers
In de organische chemie wordt de stamnaam van een koolwaterstof altijd zo gekozen dat de langste keten van aaneengesloten koolstofatomen de hoofdketen vormt. In de onderstaande afbeelding is hierover een voorbeeld te zien. De structuurformule krijgt de stamnaam hexaan omdat de langste keten zes koolstofatomen bevat. Daarnaast wordt het plaatsnummer of locant van een zijgroep, substituent of karakteristieke groep altijd zo gekozen dat de plaatsnummers zo laag mogelijk zijn. Hierover is een voorbeeld voor 2-broomhexaan weergegeven.

In een oude regel werd hiertoe naar de som van alle plaatsnummers gekeken, maar deze regel is vervangen in de recentste regels (2013). Waar vroeger de locantenset '3,4,6,8’ de voorkeur had boven ‘2,4,5,7’ omdat de som van de getallen lager is, heeft nu ‘2,4,5,7’ de voorkeur, gezien het laagste getal kleiner is. Is het laagste cijfer identiek, dan vergelijkt men het tweede laagste, enzovoort.
Remove ads
Organische chemie
Samenvatten
Perspectief
Onderstaand is een selectie van de IUPAC-aanbevelingen voor organische nomenclatuur, up-to-date met het IUPAC Blue Book (versie 2013).[1]
Koolwaterstoffen
Alkanen

Koolwaterstoffen die geen dubbele bindingen tussen koolstofatomen bevatten, worden alkanen genoemd. Als alle koolstofatomen op één lijn liggen, wordt het alkaan lineair genoemd. De naam van een lineair alkaan wordt bepaald door een stamnaam en een achtervoegsel. Het achtervoegsel voor alkanen is -aan. De stamnaam wordt bepaald door het aantal koolstofatomen dat zich in de langste aaneengesloten keten van koolstofatomen bevindt. De verschillende stamnamen zijn hieronder weergegeven. Alkanen behoren tot de verzadigde koolwaterstoffen. De eerst vijf simpele alkanen zijn hiernaast weergegeven.
Het alkaan met 20 C-atomen heeft de IUPAC-naam icosaan, niet eicosaan.
Alkenen
Koolwaterstoffen die een of meerdere dubbele binding tussen koolstofatomen bevatten worden alkenen genoemd. De naam van een lineair alkeen wordt bepaald door een stamnaam en een achtervoegsel. Het achtervoegsel voor alkenen is -een. Net als bij alkanen wordt de stamnaam bepaald door het aantal koolstofatomen in de langste aaneengesloten keten. Alkenen behoren tot de onverzadigde koolwaterstoffen.
Bij alkenen dient de locatie van de dubbele binding aangegeven te worden in de naam. Dit wordt gedaan door het plaatsnummer van het laagste koolstofatoom te noteren tussen de stamnaam en het achtervoegsel. Hierbij komt de laatste klinker van de stamnaam vaak te vervallen. Als voorbeeld is de structuurformule van de twee mogelijke pentenen weergegeven.

Als er meerdere dubbele bindingen tussen koolstofatomen aanwezig zijn, dient naast de locatie van iedere dubbele binding, ook de totale hoeveelheid dubbele bindingen aangegeven te worden. Dit wordt gedaan door een telwoord te plaatsen vóór het achtervoegsel. De a-klinker van de stam valt dan niet weg. Als voorbeeld is de structuurformule van de twee butadiënen weergegeven.

Als de plaatsing van een dubbele binding slechts op één enkele locatie mogelijk is, hoeft de locatie van de dubbele binding niet aangegeven te worden. Als voorbeeld is de structuurformule van etheen en propadieen weergegeven.

Bij alkenen kan isomerie optreden. De dubbele binding tussen koolstofatomen zorgt er namelijk voor de atomen niet vrij kunnen draaien om hun bindingsas. Dat maakt dat er Z/E-isomeren kunnen ontstaan. De descriptor Z staat hier voor het Duitse woord zusammen (vertaling: samen) en de E voor entgegen (vertaling: tegenovergesteld). Als voorbeeld is de structuurformule gegeven van de twee vormen van but-2-een. Zie voor de volledige uitwerking van dit fenomeen het artikel cis-trans-isomerie.

(2Z)-but-2-een, cis-but-2-een (links)
(2E)-but-2-een, trans-but-2-een (rechts)
Telkens heeft de eerste naam de voorkeur, maar is de tweede ook correct.
Alkynen
Koolwaterstoffen die één of meerdere driedubbele binding tussen koolstofatomen bevatten worden alkynen genoemd. De naam van een lineair alkyn wordt bepaald door een stamnaam en een achtervoegsel. Het achtervoegsel voor alkenen is -yn. Net als bij alkanen wordt de stamnaam bepaald door het aantal koolstofatomen in de langste aaneengesloten keten. Alkynen behoren tot de onverzadigde koolwaterstoffen.
Bij alkynen dient de locatie van de driedubbele binding aangegeven te worden in de naam. Dit wordt gedaan door het plaatsnummer van het laagste koolstofatoom te noteren tussen de stamnaam en het achtervoegsel. Hierbij komt de laatste klinker van de stamnaam te vervallen. Als voorbeeld is de structuurformule van pent-1-yn en pent-2-yn weergegeven.

Als er meerdere driedubbele bindingen tussen koolstofatomen aanwezig zijn, dient naast de locatie van iedere dubbele binding, ook de totale hoeveelheid driedubbele bindingen aangegeven te worden. Dit wordt gedaan door een telwoord te plaatsen vóór het achtervoegsel. De klinker a valt niet weg. Als voorbeeld is de structuurformule van penta-1,3-diyn, penta-1,4-diyn en hexa-1,3,5-triyn weergegeven.

Als de plaatsing van een driedubbele binding slechts op een enkele locatie mogelijk is, hoeft de locatie van de driedubbele binding niet aangegeven te worden. Als voorbeeld is de structuurformule van acetyleen en propyn weergegeven.

De systematische naam van het eenvoudigste alkyn is ethyn, maar de sterk ingeburgerde naam acetyleen blijft de IUPAC-voorkeur behouden. Wanneer de molecule gesubstitueerd is, wordt echter bij voorkeur op de systematische naam gebouwd (bijv. fluorethyn).
Cyclische verbindingen
Als er in een koolwaterstof een cyclische groep van koolstofatomen voorkomt, wordt deze op eenzelfde manier benoemd als het desbetreffende alkaan, alkeen of alkyn, maar wordt hier het voorvoegsel cyclo- aan toegevoegd. Het koolwaterstof met zes koolstofatomen en geen dubbele bindingen tussen de koolstofatomen, die op een cyclische manier met elkaar zijn verbonden wordt dus cyclohexaan genoemd. Als voorbeeld is de structuurformule van cyclopropaan, cyclobutaan, cyclopentaan weergegeven.

Als er een dubbele of drievoudige binding voorkomt in het cyclische koolwaterstof, gelden er dezelfde regels als bij lineaire alkenen en alkynen: de locatie van de dubbele binding moet worden aangegeven en bij meerdere dubbele bindingen dient het totaal aantal dubbele bindingen aangegeven te worden met een telwoord. Als de dubbele binding slechts op één manier geplaats kan worden, hoeft ook hier de locant niet aangegeven te worden. Als voorbeeld is de structuurformule van enkele onverzadigde zesringen weergegeven. De laatste wordt bij voorkeur benzeen genoemd.

cyclopenta-1,3-dieen (linksonder)
benzeen (cyclohexa-1,3,5-trieen) (rechtsonder)
In het geval van gesubstitueerde aromaten werd relatieve positie van zijgroepen vroeger aangeven met de voorvoegsels ortho-, meta- en para-. Deze benaming wordt in de huidige regels (2013) sterk afgeraden. Als voorbeeld zijn de drie vormen van xyleen weergegeven.

1,2-xyleen, 1,2-dimethylbenzeen of o-xyleen
1,3-xyleen, 1,3-dimethylbenzeen of m-xyleen
1,4-xyleen, 1,4-dimethylbenzeen of p-xyleen
Telkens heeft de eerste naam de voorkeur, is de tweede correct en wordt de laatste afgeraden.
Vertakkingen
In de structuurformule van een koolwaterstof kan zich naast de hoofdketen een groep van koolstof- en waterstofatomen in een zijketen bevinden. Als een koolwaterstof één of meerdere van zulke zijgroepen bevat, wordt dit een vertakt koolwaterstof genoemd. Zijgroepen worden als voorvoegsel vóór de naam van het respectievelijke lineaire koolwaterstof geschreven. De naam van een zijgroep wordt bepaald door een stamnaam en het achtervoegsel -yl. Een zijgroep met één koolstofatoom wordt dus methyl genoemd. De locatie van de zijgroep moet worden aangegeven met een locant (plaatsnummer). Als er meerdere zijgroepen met hetzelfde aantal koolstofatomen aanwezig zijn wordt voor ieder van deze zijgroepen de locatie aangegeven en wordt met een telwoord het totaal aantal zijgroepen van dezelfde soort aangegeven. Als er meerdere zijgroepen met een ander aantal koolstofatomen aanwezig is, worden deze in alfabetische volgorde in de IUPAC-naam vermeld, waarbij multiplicatieve voorvoegsels als di en tri niet in rekening worden genomen.
De hoofdketen is de langste keten in de molecule (ongeacht de aanwezigheid van eventuele onverzadigheden). De aanwezigheid van een prioritaire functionele groep of een ring kan ervoor zorgen dat een kortere keten toch als hoofdketen wordt gezien.
In de figuur zijn zeven voorbeelden van vertakten alkanen en alkenen weergegeven. Hierin is met kleuren aangegeven welke groep voor welk naamdeel zorgt.

Wanneer dit geen ambiguïteiten veroorzaakt, is het in de praktijk gebruikelijk om de locanten weg te laten. In bovenstaande voorbeelden zijn de getallen in 2-methylpropaan en 2,2-dimethylpropaan eigenlijk overbodig. In de geprefereerde IUPAC-naam worden ze echter niet weggelaten.
Functionele groepen
Alcoholen
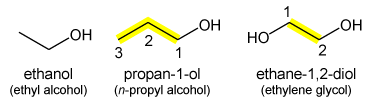
ethanol (ethylalchohol)
propaan-1-ol (propylalcohol)
ethaan-1,2-diol (ethyleenglycol)
Bij alcoholen (R-OH) wordt het achtervoegsel "-ol" toegevoegd aan de alkaan-stamnaam met een plaatsnummer voor de positie van de -OH groep/ De locant wordt zo dichtmogelijk bij de uitgang geschreven: CH3CH2CH2OH is propaan-1-ol. Methanol en ethanol zijn ondubbelzinnig en behoeven geen plaatsnummer. De achtervoegsels -diol, -triol, -tetrol, etc. worden gebruikt voor meerdere -OH-groepen: etheenglycol HOCH2CH2OH wordt bij voorkeur ethaan-1,2-diol genoemd. Oudere benamingen als ethylalcohol worden nog aanvaard maar hebben niet de voorkeur.

2-hydroxypropaanzuur
Als een karakteristieke groep met een hogere rangorde aanwezig is (zie rangorde van groepen hieronder), wordt het voorvoegsel "hydroxy" gebruikt, met zo nodig de bijbehorende positie: CH3CH(OH)COOH is 2-hydroxypropaanzuur.
Halogeenverbindingen

Halogenen krijgen als voorvoegsel het betreffende plaatsnummer en fluor, chloor, broom, jood, afhankelijk van het halogeen. Wanneer er meer dan een van hetzelfde halogeenatoom aanwezig is, worden de voorvoegsels di-, tri-, etc. gebruikt. CHCl3 (chloroform) is trichloormethaan. Verschillende substituenten worden altijd op alfabetische volgorde geplaatst, zonder daarbij op di-, tri- te letten. Het verdovingsmiddel CF3CHBrCl is 2-broom-2-chloor-1,1,1-trifluorethaan. Oudere benamingen als methylchloride worden nog aanvaard maar hebben niet de voorkeur.
Ketonen

Ketonen (R-CO-R') krijgen het achtervoegsel "-on", altijd vergezeld met een plaatsnummer: CH3COCH3 (aceton) is propaan-2-on. Als reeds een achtervoegsel voor een andere groep met een hogere rangorde werd gebruikt (zie onder voor volgorde van prioriteiten), wordt de groep C=O niet met een achtervoegsel aangeduid, maar met het voorvoegsel "oxo": CH3CH2CH2COCH3CHO is 3-oxohexanal.
Aldehyden

Aldehyden (R-CHO) krijgen het achtervoegsel "-al". Een positienummer is niet nodig – indien de aldehydegroep de hoogste rangorde heeft – daar een aldehyde zich altijd aan een uiteinde van de koolstofketen bevindt. Als er andere groepen aanwezig zijn wordt de koolstofketen zo genummerd dat het koolstofatoom van de aldehydegroep nummer "1" heeft.
Heeft de aldehydegroep niet de hoogste rangorde, dan is een positienummer soms wel noodzakelijk. Als de voorvoegselvorm vereist is, wordt "oxo" gebruikt (zoals bij ketonen), met het plaatsnummer: CHOCH3COOH is 3-oxopropaanzuur. Als het koolstofatoom van de aldehydegroep geen onderdeel is van de hoofdketen (bijvoorbeeld in het geval van cyclische aldehyden), wordt het voorvoegsel "formyl" of het achtervoegsel "carbaldehyde" gebruikt: C6H11CHO is cyclohexaancarbaldehyde.
De kleinste ongesubstitueerde aldehyden worden bij voorkeur formaldehyde (HCHO) en acetaldehyde (CH3CHO) genoemd, eerder dan bij de systematische namen methanal en ethanal.
Carbonzuren

Carbonzuren (R-COOH) krijgen het achtervoegsel "zuur". Het C-atoom van de zuurgroep wordt nummer "1" van de keten en een plaatsnummer is niet nodig. Bijvoorbeeld CH3CH2COOH propaanzuur. De kleinste ongesubstitueerde carbonzuren worden bij voorkeur mierenzuur en azijnzuur genoemd in plaats van methaanzuur en ethaanzuur.
Als er twee carboxylgroepen zijn in dezelfde keten, wordt het achtervoegsel "-dizuur". Bij drie of meer carboxylgroepen wordt het achtervoegsel "-carbonzuur" gebruikt. In deze gevallen tellen de koolstofatomen van de carboxylgroepen COOH niet mee als onderdeel van de hoofdketen. Hetzelfde geldt voor het voorvoegsel "carboxyl", dat soms wordt gebruikt. Citroenzuur is een voorbeeld; de voorkeursnaam is 2-hydroxypropaan-1,2,3-tricarbonzuur.
Ethers

methoxymethaan (dimethylether)
methoxyethaan (ethylmethylether)
2-methoxypropaan (isopropylmethylether)
Ethers (R-O-R') bestaan uit een zuurstofatoom verbonden met twee koolstofketens. De kortste van de twee ketens bepaalt het eerste deel van de naam, met achtervoegsel "-oxy", de langste koolstofketen bepaalt de stamnaam van de ether. Dus CH3OCH3 is methoxymethaan en CH3OCH2CH3 is methoxyethaan (niet ethoxymethaan). Als het zuurstofatoom op meerdere plaatsen verbonden kan worden aan de hoofdketen van het alkaan, dan wordt de alkyloxy-groep voorzien van een locant, bijvoorbeeld: CH3OCH(CH3)2 is 2-methoxypropaan. Oudere benamingen als ethylmethylether en di-ethylether worden nog aanvaard maar hebben niet de voorkeur.
Esters
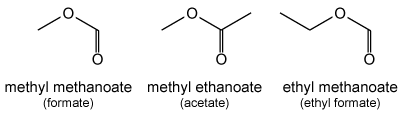
methylformiaat (methylmethanoaat)
methylacetaat (methylethanoaat)
ethylformiaat (ethylmethanoaat)
Esters (R-CO-O-R') worden benoemd met het achtervoegsel "-oaat" achter de alkaannaam voor R. Daarvóór komt de naam van de alkylgroep R'. Bijvoorbeeld: CH3CH2COOCH3 is methylpropanoaat. Bij voorkeur worden de namen formiaat en acetaat gebruikt in plaats van de systematische methanoaat en ethanoaat.
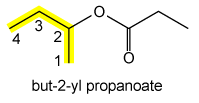
De alkylgroep R' kan ook vertakt zijn: CH3CH2CH(CH3)OOCCH2CH3 is but-2-ylpropanoaat.
Aminen

(boven v.l.n.r.)
methaanamine of methylamine
propaan-1-amine of propylamine
propaan-2-amine of isopropylamine
(onder v.l.n.r.)
N-methylethaanamine of ethyl(methyl)amine
N-ethyl-N-methylpropaan-1-amine of ethyl(methyl)(propyl)amine
Aminen (R-NH2) worden genoemd naar het overeenkomstige alkaan met het achtervoegsel "-amine" (bijvoorbeeld CH3NH2 methaanamine). Indien nodig wordt de positie van de aminogroep NH2 toegevoegd: CH3CH2CH2NH2 propaan-1-amine, CH3CHNH2CH3 propaan-2-amine. Het voorvoegsel "amino" wordt gebruikt als in het molecuul nog een karakteristieke groep met een hogere rangorde aanwezig is. Oudere benamingen als methylamine worden nog aanvaard maar hebben niet de voorkeur.
Bij secundaire aminen (met de vorm R-NH-R') bepaalt de langste koolstofketen aan het stikstofatoom de stamnaam van het amine; de andere keten wordt voorgevoegd als een alkylgroep met als locant een cursief geschreven N: CH3NHCH2CH3 is N-methylethaanamine. Tertiaire aminen (R-NR'-R") worden op dezelfde manier behandeld: CH3CH2N(CH3)CH2CH2CH3 is N-ethyl-N-methylpropaan-1-amine.
Amiden
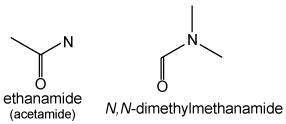
twee waterstoffen ontbreken in CH3CONH2
acetamide (ethaanamide) (links)
dimethylformamide (N,N-dimethylmethaanamide) (rechts)
Amiden (R-CO-NH2) krijgen het achtervoegsel "-amide" en behoeven geen plaatsnummer, aangezien amiden altijd de koolstofketen afsluiten, bijvoorbeeld CH3CH2CONH2 is propaanamide. Er bestaat geen vorm voor een voorvoegsel voor wanneer de amidefunctie niet prioritair is. In dat geval ziet men de oxogroep en de aminogroep als twee substituenten op de hoofdketen.
Secundaire en tertiaire amiden worden op dezelfde manier behandeld als aminen: alkylgroepen aan het stikstofatoom worden behandeld als substituenten met als plaatsvoorvoegsel N: HCON(CH3)2 heet systematisch N,N-dimethylmethaanamide. De voorkeursnaam is echter dimethylformamide. De aanduiding N is hier overbodig, gezien er geen andere substitueerbare waterstofatomen aanwezig zijn. En de kleinste amiden worden bij voorkeur formamide en acetamide genoemd in plaats van bij de systematische namen methaanamide en ethaanamide.
Cyclische verbindingen
Cycloalkanen en aromatische verbindingen kunnen worden behandeld als de hoofdketen van de chemische stof, waarbij de positie van de substituties worden genummerd rond de ringstructuur. Omdat de IUPAC-naam van cyclische verbindingen snel complex en lang kan worden, hebben binnen de IUPAC-nomenclatuur veel niet-systematische namen zoals aniline, fenol, furaan, xyleen en indool de voorkeur. Ze kunnen ook dienen als stamnamen wanneer de ring verder gesubsitueerd wordt, bijvoorbeeld 2-broomfenol. Andere namen zoals cumeen en styreen worden wel nog erkend maar hebben nooit de voorkeur. Zie ook bovenstaand voorbeeld van de drie isomeren van xyleen.
De cyclische structuren kunnen zelf ook worden beschouwd als karakteristieke groepen, waarvan de namen als voorvoegsel "cycloalkyl" (bijvoorbeeld "cyclohexyl") of voor benzeen, "fenyl" luiden.
Rangorde van functionele groepen
Als koolstofverbindingen meer dan een karakteristieke groep bevatten, bepaalt onderstaande rangorde (zie tabel) welke groep als achtervoegsel en welke groep(en) als voorvoegsel worden genoemd. De hoogste prioriteit bepaalt het achtervoegsel, alle anderen worden als voorvoegsel genoemd. De naam krijgt slechts één achtervoegsel.
Dubbele en drievoudige bindingen worden hier niet 'groep' beschouwd. Zij wijzigen de uitgang -aan in -een of -yn, wat nog vóór een eventueel achtervoegsel komt. Halogenen en ethers worden altijd als substituent genoemd met een voorvoegsel, en kom komen dus niet voor in onderstaande tabel, die de prioriteiten van de achtervoegsel weergeeft.
Karakteristieke groepen die met voorvoegsels worden aangegeven, worden op alfabetische volgorde geplaatst (eventuele numerieke voorvoegsels zoals di-, tri-, etc. tellen hiervoor niet mee), bijvoorbeeld chloorfluormethaan, niet fluorchloormethaan. Als er meer identieke groepen voorkomen, zijn de plaatsnummers oplopend (dus ethaan-1,2-diol, niet ethaan-2,1-diol.) De N als positie-indicatie voor aminen en amiden komt vóór de getallen, bijvoorbeeld CH3CH(CH3)CH2NH(CH3) is N,2-dimethylpropaan-1-amine.
Onderstaande tabel is opgesteld analoog aan die in de beknopte handleiding voor de nomenclatuur van de organische chemie.[2] Een koolstofatoom tussen haakjes betekent hier dat deze deel is van de hoofdketen, bijv. CH3CH2C≡N propaannitril maar C6H5C≡N benzeencarbonitril (bij voorkeur het niet-systematische benzonitril).
Met bovenstaande regels kan men reeds een groot aantal organische structuren benoemen. Maar het gaat nog veel verder: er zijn complexere ringstructuren, heteroatomen, specifieke isotopen, biomoleculen, stereo-isomeren, radicalen, etc. De complete IUPAC-regels voor organische chemie waarmee alle moleculen benoemd kunnen worden, zijn beschreven in een bundel van over de 1100 pagina's (het zgn. Blue Book) en is gratis te downloaden via de site van IUPAC.
Remove ads
Anorganische chemie
Samenvatten
Perspectief
Onderstaand is een selectie van de IUPAC-aanbevelingen voor anorganische nomenclatuur, up-to-date met het Red Book (versie 2005).[3]
Enkelvoudige stoffen
De naam van een enkelvoudige stof wordt bepaald door de atoomsoort waar het element uit bestaat. In de meeste gevallen is de naam van de enkelvoudige stof hetzelfde als de naam van het element. Voorbeelden van zulke stoffen zijn: helium, ijzer en koolstof. Sommige elementen komen echter voor als meeratomige moleculen. Deze elementen krijgen een telwoord (prefix) vóór hun naam om het aantal atomen in het molecuul aan te geven. Enkele voorbeelden zijn in de onderstaande tabel weergegeven.
Ionen met één atoomsoort
Met een multiplicatief voorvoegsel geeft men aan uit hoeveel atomen het ion bestaat, waarbij mono wordt weggelaten. Daarna volgt de naam van het element, dat in geval van een anion de uitgang -ide heeft. De lading van het ion wordt tussen haakjes weergegeven. Bij de anionen mag de lading weggelaten worden wanneer hierdoor geen verwarring ontstaat.
De namen ferro-ion en ijzer(II)ion zijn verouderd. Volgens de huidige aanbevelingen is ijzer(2+) correct voor Fe2+.
Binaire verbindingen

Stoffen die uit twee atoomsoorten bestaan worden binaire verbinding genoemd. De volgorde waarin de atomen vermeld worden, zowel in de formule als in de naam, wordt bepaald via de hiernaast weergegeven figuur. Het element dat eerst door de pijl bereikt wordt, wordt gezien als meest elektronegatief, staat als tweede in de formule en naam, en krijgt de uitgang "ide".
Het aantal atomen in een binaire verbinding wordt aangegeven met een telwoord (prefix) dat vóór de atoomnaam wordt geplaatst. Het telwoord voor één (mono) mag steeds weggelaten worden, maar wordt soms ter verduidelijking toegevoegd om het onderscheid te maken met gelijkende verbindingen (zoals bij CO en NO).
De notaties met oxidatiegetallen of ladingsgetallen in plaats van telwoorden zijn ook toegestaan. En wanneer er geen verwarring mogelijk is, mogen de telwoorden ook achterwege gelaten worden.
Het naamgevingsprincipe van de binaire verbindingen is eenvoudig uit te breiden. Men deelt alle elementen in de formule op in elektropositief en elektronegatief. Eerst noemt men in alfabetische volgorde de elektropositieve elementen, daarna de elektronegatieve elementen, ook in alfabetische volgorde en alle met de uitgang "ide". De alfabetische volgordes kunnen verschillen in de formule en in de naam.
Als een ion dat reeds een telwoord bevat meer dan één keer voorkomt in de verhoudingsformule, wordt deze in de IUPAC-naam tussen haakjes weergegeven. Vóór de naam van het samengestelde ion wordt het complexe telwoord (bis, tris, tetrakis ...) geschreven. Zo krijgt het zout dat bestaat uit Fe3+-ionen en I3–-ionen de naam: ijzertris(tri-jodide). Hierbij geeft het enkelvoudige telwoord tri aan dat het I3–-ion uit drie joodatomen bestaat. Het complexe telwoord tris geeft aan dat er drie I3--ionen aanwezig zijn in de verhoudingsformule. In een verbinding als FeI3 komt het I–-ion driemaal voor, en zal men ook het complexe voorvoegsel tris gebruiken. Dit om de verwarring met het tri-jodide-ion te vermijden.
In sommige gevallen kan het voorkomen dat het niet duidelijk is welke lading het positieve en negatieve ion hebben. Dit komt bijvoorbeeld voor bij O22– (peroxide) en O2– (superoxide). De formule Pb(O2)2 kan namelijk verwijzen naar het zout dat bestaat uit Pb4+-ionen en O22–-ionen of naar het zout dat bestaat uit Pb2+-ionen en O2–-ionen. Daarom wordt in deze gevallen de lading van het positieve en negatieve ion aangegeven. De respectievelijke namen zijn dan: lood(4+)bis[dioxide(2–)] en lood(2+)bis[dioxide(1–)] of lood(4+)peroxide en lood(2+)superoxide. Hetzelfde geldt wanneer het oxide(2–)-ion twee maal voorkomt, kan men ook bis(oxide) schrijven in plaats van dioxide. Looddioxode (PbO2) kan beter benoemd worden als lood(4+)bis(oxide) om de verwarring met lood(2+)dioxide(2–) te vermijden, dat dezelfde formule en stoichiometrische naam heeft.
Additieve nomenclatuur
De zogenaamde additieve nomenclatuur is een nomenclatuursysteem dat oorspronkelijk ontwikkeld is voor coördinatieverbindingen, maar nu een algemene toepassing kent voor moleculaire structuren. De structuur wordt bekeken als één of meerdere centrale atomen met daarop gebonden liganden.
De naam van een elektrisch neutraal ligand is identiek aan de naam de neutrale molecule. Uitzonderingen zijn de ligandnamen aqua, ammine, carbonyl en nitrosyl voor resp. H2O, NH3, CO en NO. De naam van een negatief geladen ligand, normaal eindigend op "ide", "aat" of "iet", wordt aangepast met de uitgang "ido", "ato" of "ito". Bijvoorbeeld: chloride wordt chlorido, sulfaat wordt sulfato, nitriet wordt nitrito.
In de formule, die vaak tussen rechte haken wordt geplaatst, wordt eerst het centrale atoom genoemd, daarna de liganden in alfabetische volgorde. In de naam worden eerst de liganden genoemd in alfabetische volgorde (die kan verschillen van de volgorde in de formule), en volgt nadien de naam van het centrale atoom. Indien de structuur een negatieve lading heeft, krijgt het centrale element de uitgang "aat". Achteraan wordt de totale lading van het ion toegevoegd, of het oxidatiegetal van het centrale element. Komt een ligand meermaals voor gebruikt men een multiplicatief voorvoegsel di, tri, … Men gebruik bis, tris … in geval van mogelijke verwarring of wanneer in het ligand reeds een prefix di, tri … aanwezig is.
Hier volgen enkele eenvoudige voorbeelden met één centraal element.
Zuren en zuurresten
Binaire zuren worden typisch benoemd via de naamgeving voor binaire verbindingen. De corresponderende zuurresten zijn monoatomische anionen, en volgen ook de gewoonlijke naamgeving zoals hierboven beschreven. Ternaire zuren en bijhorende zuurresten kunnen daarentegen benoemd worden via de additieve naamgeving, maar vele zijn ook gekend onder een (niet-systematische) traditionele naam. Hetzelfde geldt voor dubbelzuren, thiozuren, peroxyzuren en andere afgeleiden.
Vertrekt men van een anion en voegt men een of meerdere hydronen toe, schrijft men een telwoord, waterstof, de naam van het anion tussen haakjes, en ten slotte (indien verschillend van nul) de elektrische lading van het geheel. Bijvoorbeeld H2PO4– diwaterstof(fosfaat)(1–) of diwaterstof(tetraoxidofosfaat)(1–). Bij courante ionen mogen de haakjes en lading eventueel worden weggelaten: diwaterstoffosfaat. Op welke plaats de hydronen op het anion worden gebonden is in deze naam ongespecificeerd. Zo slaat waterstof(cyanaat) zowel op cyaanzuur als isocyaanzuur.
Wanneer de haakjes en lading worden weggelaten ontstaan mogelijks ambiguïteiten. Zo is waterstof(sulfide)(1–) een niet mis te verstane aanduiding voor HS–, maar vereenvoudigt men dit tot waterstofsulfide, dan ontstaat er verwarring met H2S. Deze laatste heet diwaterstofsulfide volgens de naamgeving van binaire verbindingen, maar het prefix di mag eventueel worden weggelaten, wat eveneens tot de naam waterstofsulfide leidt. Om dergelijke ambiguïteiten te vermijden, wordt in het IUPAC Red Book de voorkeur gegeven aan resp. waterstof(sulfide)(1–) en diwaterstofsulfide, en wordt aangeraden om voorzichtig om te springen met ambigue namen als waterstofsulfide.
Zouten
De complexe ionen en de zuurresten, benoemd met een additieve of traditionele naam, kunnen gecombineerd worden met tegenionen tot zoutverbindingen. Voor de formule en de naam worden dezelfde regels toegepast als voor de eenvoudigere verbindinen: men ordent alle kationen alfabetisch en alle anionen alfabetisch. Wanneer een ion meermaals voorkomt, gebruikt men voorvoegsels di, tri, … of bis, tris, … in geval het ion zelf al een prefix bevat en in geval van mogelijke verwarring, bijvoorbeeld vanwege het bestaan van de dizuren en trizuren. Wanneer dit geen ambiguïteiten creëert, mogen de prefixen worden weggelaten.
Hydraten, adducten, dubbelzouten
Voor zouthydraten, adducten en andere verbindingen die formeel uit meerdere componenten bestaan, worden de verschillende formule-onderdelen gerangschikt in toenemend aantal, en in alfabetische volgorde indien gelijk aantal. Water wordt steeds als laatste vermeld. Tussen elke component wordt een hoge punt geplaatst.
De naam wordt opgebouwd uit alle namen van de verschillende onderdelen, op eenzelfde manier geordend en gescheiden door een kastlijntje. Na de naam volgt tussen haakjes de stoichiometrische verhouding in welke de onderdelen voorkomen.
De oudere benaming met "hydraat" wordt ook nog aanvaard: magnesiumsulfaatheptahydraat.
Overige toegestane naamgevingen
De eerder genoemde naamgevingen voor anorganische verbindingen berusten op een aanpassing van de IUPAC-regels die is ingegaan in 2015. In veel vakliteratuur komt echter nog de oude naamgeving voor. Deze naamgeving is nog steeds toegestaan door de IUPAC, maar de nieuwe vorm heeft de voorkeur. In de oude naamgeving worden bij zouten geen telwoorden gebruikt. In gevallen dat een verhoudingsformule bij meerdere namen zou kunnen horen, wordt de lading van het overgangsmetaal aangegeven met een Romeins cijfer. De nieuwe IUPAC-naam di-ijzertrioxide mag dus nog steeds ijzer(III)oxide worden genoemd.
Remove ads
Triviale namen
Naast de IUPAC-nomenclatuur worden er in het dagelijks leven vaak andere namen voor stoffen gebruikt. Deze namen worden triviale namen genoemd. De praktische toepassing van triviale namen maakt vooral het spreken over moeilijk stoffen makkelijker. Een IUPAC-naam is soms namelijk erg lang, wat de gesproken communicatie niet ten goede komt.
Zie ook
Externe link
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
