Trippelbinding
From Wikipedia, the free encyclopedia
Remove ads
En trippelbinding i kjemi er en kjemisk binding mellom to atomer som involverer seks bindende elektroner i stedet for de vanlige to i en kovalent enkeltbinding. Trippelbindinger er sterkere enn tilsvarende enkeltbindinger eller dobbeltbindinger, med en bindingsorden på tre. Den vanligste trippelbindingen, den mellom to karbonatomer som finnes i alkyner. Andre funksjonelle grupper som inneholder en trippelbinding er cyanider og isocyanider. Noen diatomiske molekyler, som dinitrogen og karbonmonoksid, er også trippelbundet. I skjelettformler er trippelbindingen tegnet som tre parallelle linjer (≡) mellom de to sammenkoblede atomene.[1][2][3]
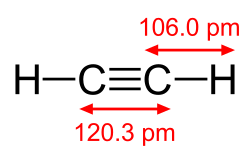 |
 |
 |
| acetylen, H−C≡C−H | cyanogen, N≡C−C≡N | karbonmonoksid, C≡O |

Remove ads
Binding
Bindingstypene kan forklares i form av orbital hybridisering. Når det gjelder acetylen, har hvert karbonatom to sp-orbitaler og to p-orbitaler. De to sp-orbitalene er lineære med 180° vinkler og okkuperer x-aksen (kartesisk koordinatsystem). P-orbitalene er vinkelrette på y-aksen og z-aksen. Når karbonatomene nærmer seg hverandre, overlapper sp-orbitalene for å danne en sp-sp sigma-binding. Samtidig nærmer pz-orbitalene seg og sammen danner de en pz-pz pi-binding. På samme måte danner det andre paret py-orbitaler en py-py pi-binding. Resultatet er dannelse av en sigma-binding og to pi-bindinger.
I den bøyde bindingsmodellen kan trippelbindingen også dannes ved overlapping av tre sp3-lober uten at det er nødvendig å danne en pi-binding.[4]
Remove ads
Referanser
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
