Acid percloric
component quimic From Wikipedia, the free encyclopedia
Remove ads
L’acid percloric es un compausat quimic de formula HClO4. Es un acid fòrt e un oxidant poderós, comparable a l'acid nitric ò a l'acid sulfuric. Es mai que mai utilizat en metallurgia (tractaments electrolitics, etc.), dins l'industria quimica (matèria premiera per la produccion de perclorats, agent d'oxidacion, agent de desidratacion, etc.) e en quimia analitica (analisi dei metaus, etc.). Son utilizacion necessita de precaucions particularas car es una substància corrosiva e comburanta que pòu aisament formar de compausats explosius.

Remove ads
Istòria
L'acid percloric foguèt descubèrt au començament dau sègle XIX. Sa premiera sintèsi es tradicionalament atribuïda au quimista austrian Friedrich von Stadion (1774-1821) e es situada dins lo corrent deis ans 1810. Lo compausat foguèt inicialament dich « acid cloridric oxigenat » e prenguèt son nom actuau amb la definicion progressiva dei règlas de nomenclatura.
Sintèsi
Procès industriaus
Dos procès industriaus son utilizats per produrre d'acid percloric. Lo premier utiliza consistís a tractar una solucion de perclorat de sòdi NaClO4 amb d'acid cloridric HCl. La reaccion entraïna la formacion d'acid percloric e de clorur de sòdi NaCl segon la reaccion :
- NaClO4 + HCl → NaCl(s) + HClO4
Lo clorur de sòdi solid pòu èsser eliminat sota forma de precipitat.
Lo segond procès permet de defugir l'utilizacion de saus. Es tanben mai dirècte. Consistís a recuperar l'acid percloric format a l'anòde durant l'electrolisi d'una solucion aquosa de diclòr. Pasmens, l'anòde utilizat per aquela reaccion dèu èsser un electròde de platin[1][2].
Metòdes de laboratòri
En laboratòri, plusors metòdes permèton de produrre d'acid perclorat. Un dei pus simples es de destillar una solucion de perclorat de potassi e d'acid sulfuric[3]. Es tanben possible de sintetizar d'acid percloric a partir d'una reaccion entre lo perclorat de bari e l'acid sulfuric. Similara au procès industriau basat sus la sau de perclorat de sòdi, aquela reaccion entraïna la formacion d'un precipitat de perclorat de bari que permet de recuperar d'acid percloric liquid.
Remove ads
Caracteristicas e proprietats
Proprietats fisicas

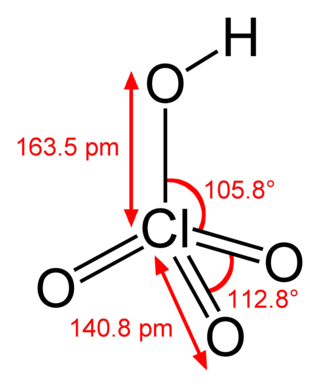
Dins lei condicions normalas de temperatura e de pression, l'acid percloric anidre es un liquid oliós, incolòr, fòrça igroscopic e instable[4]. Sa massa volumica es de 1,768 g/cm3 a 22 °C e son ponch de fusion es de -112 °C. Es miscible a l'aiga, mai la dissolucion es acompanhada d'una importanta liberacion de calor. En causa d'aquela reactivitat, l'acid percloric anidre es pas comercializat. En revènge, de solucions contenent entre 50 e 70 % d'acids son disponiblas[4].
Proprietats quimicas
L'acid percloric es un acid fòrt que tèn un pKa estimat a −15,2 ± 2,0[5]. Fa ansin partida deis acids de Bronsted pus poderós de la quimia modèrna. Aquò conferís a l'acid percloric anidre de proprietats oxidantas poderosas, mai lo compausat es instable e se desgrada pauc a cha pauc a temperatura ambienta. De mai, pòu espetar a partir de 75 °C e sei produchs de degradacion (diclòr, dioxid de clòr, etc.) son toxics[4].
Per aquelei rasons, la mesa en òbra de l'acid percloric se fa generalament sota la forma de solucions aquosas concentradas. Aquelei solucions demòran fòrça oxidantas e pòdon engendrar de reaccions explosivas amb mai d'un compausat (alcòls, glicòls, cetonas, etèrs, gliceròl, sulfoxids, acier, bismut, antimòni, etc.)[4]. Lei reaccions amb leis agents desidratants, coma l'acid sulfuric, son tanben perilhosas car pòdon menar a la formacion d'eptaoxid de diclòr, un compausat explosiu[4][6]. Fòrça metaus e polimèrs son egalament atacats per l'acid percloric.
Pasmens, en despiech d'aquelei riscs, l'acid percloric es interessant en quimia organica car es un nucleofil fòrça feble. La màger part de sei saus son tanben solubles dins l'aiga. Es ansin preferit a d'autreis acids per menar certanei sintèsis organicas e intra dins la composicion d'eluents de cromatografia[7].
Utilizacions
L'acid percloric es utilizat dins tres domenis principaus[4]. I a d'aplicacions variadas. En metallurgia, es utilizat dins de procès d'aliscatge electroquimics de metauss, especialament l'alumini e lo molibdèn. Intra egalament dins la composicion de plusors tipes de banhs electrolitics. Dins l'industria quimica, l'acid percloric es un precursor dei perclorats, una familha de compausats importants en pirotecnica. Pasmens, en causa de sei proprietats quimicas, i es tanben utilizat coma agent oxidant, agent de desidratacion ò catalisaires. Aquelei proprietats son egalament utilizadas en electronica per gravar de metaus coma lo cròme. Enfin, en quimia analitica, l'acid percloric es utilizat en cromatografia per fabricar d'eluents ò coma reactius per degradar d'autrei compausats. Per exemple, en geoquimia, l'acid percloric permet de digerir lei silicats ò la matèria organica avans analisi.
Remove ads
Toxicologia e seguretat
L'acid percloric es un agent corrosiu poderós que pòu entraïnar de lesions grèvas dei teissuts biologics[4]. Es tanben un comburant poderós e la forma anidra ò sei solucions pòdon facilitar ò accelerar un incendi. L'utilizacion e l'estocatge de l'acid percloric son donc somés a de condicions de seguretat estrictas dins la màger part dei país. En revènge, pauc d'elements son coneguts a prepaus de sa toxicitat per l'èsser uman. Una ingestion cronica auriá d'efiechs negatius au nivèu dei rens e dau sistèma digestiu. Ges d'efiech cancerigèn es estat identificat.
Remove ads
Annèxas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads