Tlenki węgla – związki chemiczne składające się z węgla i tlenu[uwaga 1].
Najprostsze i spotykane powszechnie tlenki węgla to tlenek węgla (CO) i dwutlenek węgla (CO2). Poza nimi znanych jest wiele innych trwałych lub metatrwałych tlenków węgla, np. tzw. podtlenek węgla (ditlenek triwęgla, O=C=C=C=O) odkryty przez Brodiego w 1873 roku[4] i bezwodnik melitowy (C12O9) opisany przez Meyera i Steinera w 1913 roku[5][6][7]. W roku 1859 Brodie opisał też tzw. tlenek grafitu[8], który jednak według współczesnej wiedzy zawiera także liczne grupy hydroksylowe[9] (z tlenku grafitu można uzyskać tlenek grafenu o jednowarstwowej strukturze analogicznej do grafenu[9]).
| |
 |
|
 |
|
 |
|
 |
| |
CO
Tlenek
węgla |
|
CO2
Dwutlenek
węgla |
|
C3O2
Podtlenek
węgla |
|
C12O9
Bezwodnik
melitowy
|
Przez wiele dziesiątków lat te związki były powszechnie uważane za jedyne trwałe tlenki węgla. Jednak od lat 60. XX wieku utworzono nowe związki, z których część była trwała w temperaturze pokojowej. Niektóre były metatrwałe lub trwałe tylko w bardzo niskich temperaturach i rozkładały się na prostsze po ogrzaniu. Wiele było nietrwałych, które mogły być obserwowane jako etapy przejściowe reakcji chemicznych, lub tak reaktywnych, że mogły istnieć tylko w fazie gazowej lub w warunkach izolacji matrycowej. Ważne przykłady tych ostatnich to monotlenek diwęgla (rodnik: C=C=O), tritlenek węgla (CO3)[10] i 1,2-dioksoetandion (C2O4)[11][12]. Niektóre z tych reaktywnych tlenków węgla zostały wykryte w obłokach molekularnych w przestrzeni międzygwiazdowej dzięki spektroskopii rotacyjnej[13].
Wiele hipotetycznych tlenków węgla badano metodami teoretycznymi, np. bezwodnik szczawiowy (C2O3 albo O=(C2O)=O), etylenodion (C2O2 albo O=C=C=O)[14] i inne liniowe lub pierścieniowe polimery tlenku węgla (−C(=O)–)n (poliketony)[15] oraz liniowe i pierścieniowe polimery dwutlenku węgla −(O−C(=O)–)n, jak dimer 1,3-dioksetanodion (C2O4)[16] i trimer 1,3,5-trioksanotrion (C3O6)[16][17].
| |
 |
|
 |
|
 |
|
 |
|
 |
| |
C2O3
Bezwodnik
szczawiowy |
|
C2O4
1,2-Dioksetano-
dion |
|
C2O4
1,3-Dioksetano-
dion |
|
C3O6
1,3,5-Trioksano-
trion |
|
C2O2
Etyleno-
dion
|
Liczba znanych tlenków węgla wciąż rośnie. Istnienie tlenku grafitu i innych trwałych polimerycznych tlenków węgla o nieograniczonej strukturze molekularnej[18][8] sugeruje, że wiele innych pozostało do odkrycia.
Liniowe dwutlenki węgla tworzą szereg homologiczny o wzorze ogólnym CnO2 lub O=(C=)nO. Zbudowane są z prostego łańcucha atomów węgla połączonych skumulowananymi wiązaniami podwójnymi i zakończonego na obu końcach atomami tlenu. Pierwsi przedstawiciele szeregu to
- CO2 albo O=C=O, dwutlenek węgla.
- C2O2 albo O=C=C=O, skrajnie nietrwały etylenodion[14].
- C3O2 albo O=C=C=C=O, metatrwały podtlenek węgla albo ditlenek triwęgla.
- C4O2 albo O=C=C=C=C=O, ditlenek tetrawęgla albo 1,2,3-butatrien-1,4-dion[19]
- C5O2 albo O=C=C=C=C=C=O, ditlenek pentawęgla[20], trwały w roztworze w temperaturze pokojowej, a w postaci czystej poniżej −90 °C[21].
Wyższe człony tego szeregu odkryto w ilościach śladowych w gazach pod niskim ciśnieniem lub eksperymentach z macierzami kriogenicznymi, zwłaszcza dla n = 7[21] oraz n = 17, 19 i 21[22].
Inną grupą tlenków węgla są liniowe tlenki węgla CnO. Pierwszy członek, zwykły tlenek węgla CO, wydaje się być jedynym trwałym w stanie czystym w temperaturze pokojowej. Fotoliza liniowych dwutlenków węgla w macierzy kriogenicznej prowadzi do utraty CO i powstania wykrywalnych ilości jednotlenków o parzystej liczbie atomów węgla takich jak C2O, C4O[23] i C6O[21]. Człony do n = 9 uzyskano też przy wyładowaniach elektrycznych w gazowym C3O2 wymieszanym z argonem[24]. Pierwsze trzy człony szeregu obserwowano w przestrzeni międzygwiezdnej[24].
Uważa się, że kiedy n jest parzyste, cząsteczki są w stanie trypletowym (jak kumuleny), z atomami połączonymi wiązaniami podwójnymi i niezapełnionym orbitalem pierwszego węgla – jak w: C=C=O: C=C=C=C=O i ogólnie: (C=)n=O. Kiedy n jest nieparzyste, struktura trypletowa jest prawdopodobnie w rezonansie z singletową (jak w acetylenie) polarną strukturą z ładunkiem ujemnym na końcu węglowym i dodatnim na atomie tlenu, jak w −+C≡C−C≡O, −+C≡C−C≡C−C≡O i ogólnie −(C≡C–)n/2C≡O+[24]. Tlenku węgla też dotyczy ta struktura: za dominującą formę jest uważana −+C≡O[25].
Inną interesującą rodziną tlenków węgla są cykliczne radialenowe tlenki CnOn albo (CO)n[26]. Mogą być uważane za pierścieniowe polimery tlenku węgla lub n-krotne ketony n-węglowych cykloalkanów. Pierwsze dwa człony to sam tlenek węgla (CO) i skrajnie nietrwały etylenodion C2O2 albo O=C=C=O[14]. Teoretyczne analizy sugerują, że następne cztery człony szeregu – C3O3, C4O4, C5O5 i C6O6 – mogą być trwałe, ale dotąd udało się je wytworzyć tylko w śladowych ilościach[27].
| |
 |
|
 |
|
 |
|
 |
| |
(CO)3
Cyklopropano-
trion |
|
(CO)4
Cyklobutano-
tetron |
|
(CO)5
Cyklopentano-
penton |
|
(CO)6
Cykloheksano-
hekson
|
Z drugiej strony aniony tych związków są dość stabilne, a niektóre z nich są znane od XIX wieku[26]. Są to:
- C2O2−2, anion acetylenodiolowy (Weiss i Büchner, 1963)[28]
- C3O2−3, anion kwasu deltowego (dihydroksycyklopropanonu; Eggerding i West, 1976)[29][30],
- C4O2−4, anion kwasu kwadratowego (1,2-dihydroksycyklobutano-3,4-dionu; Cohen i inni, 1959)[31]
- C5O2−5, anion kwasu krokonowego (1,2-dihydroksycyklopentano-3,4,5-trionu; Gmelin, 1825)[32]
- C6O2−6, anion kwasu rodyzonowego (1,2-dihydroksycykloheksano-3,4,5,6-tetronu; Heller, 1837)[33][34].
Tlenek C6O6 tworzy też trwałe aniony tetrahydroksybenzochinonu (C6O4−6) i heksahydroksybenzenu (C6O6−6)[35]. Aromatyczność tych anionów była badana metodami teoretycznymi[36][37].
Wiele nowych trwałych i metatrwałych tlenków otrzymano począwszy od lat 60. XX wieku. Należą do nich:
- C12O12 albo C6(C2O4)3, tris(szczawian) heksahydroksybenzenu (1967); trwały jako solwat tetrahydrofuranu[38].
- C10O10 albo C6O2(C2O4)2, bis(szczawian) tetrahydroksy-p-benzochinonu (1968); trwały jako solwat tetrahydrofuranu[39]
- C8O8 albo C6O2(CO3)2, bis(węglan) tetrahydroksy-p-benzochinonu (1984); rozkłada się w temperaturze około 45–53 °C[40].
- C9O9 albo C6(CO3)3, tris(węglan) heksahydroksybenzenu (1984); rozkłada się w temperaturze około 45–53 °C[40].
- C24O6 i C32O8, odpowiednio pierścieniowy trimer i tetramer podwójnego rodnika, 3,4-dialkinylo-3-cyklobuteno-1,2-dionu −C≡C−(C4O2)−C≡C− (1990)[41]
- C4O6, dioksanotetron albo dimer bezwodnika szczawiowego (1998); trwały w Et2O w temperaturze −30 °C, rozkłada się w temperaturze 0 °C[42].
- C12O6, heksaoksotricyklobutabenzen (2006)[43][44]
| |
 |
|
 |
|
 |
| |
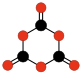
C10O10
Bis(szczawian)
tetrahydroksy-
1,4-benzochinonu |
|
C8O8
Bis(węglan)
tetrahydroksy-
1,4-benzochinonu |
|
C4O6
Dioksano-
tetron |
| |
 |
|
 |
|
 |
| |
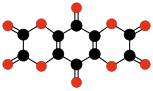
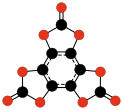
C12O12
Tris(szczawian)
heksahydroksybenzenu |
|
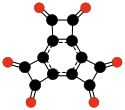
C9O9
Tris(węglan)
heksahydroksybenzenu |
|
C12O6
Heksaoksotricyklo-
butabenzen |
| |
 |
|
 |
| |
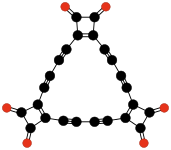
C24O6
Tris(3,4-dialkinyl-
3-cyklobuteno-
1,2-dion) |
|
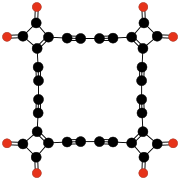
C32O8
Tetrakis(3,4-dialkinyl-
3-cyklobuteno-
1,2-dion)
|
W literaturze anglojęzycznej funkcjonuje termin oxocarbons (analogicznie w niektórych innych językach) oznaczający wg IUPAC związki zbudowane wyłącznie z węgla i tlenu[1]. Został on wprowadzony w roku 1963 przez Roberta Westa(inne języki) i Davida L. Powella[2][3]. West definiuję tę nazwę nieco inaczej niż IUPAC, jako związki, w których wszystkie lub prawie wszystkie atomy węgla tworzą układy karbonylowe (C=O) lub enolowe (C=C–OH), lub ich formy hydratowane lub deprotonowane[2]. W polskiej nomenklaturze chemicznej analogiczny termin nie jest stosowany.
Oxocarbons, [w:] A.D.A.D. McNaught A.D.A.D., A.A. Wilkinson A.A., Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.O04375, ISBN 0-9678550-9-8 (ang.). Robert West, David L. Powell. New Aromatic Anions. III. Molecular Orbital Calculations on Oxygenated Anions. „Journal of the American Chemical Society”. 85 (17), s. 2577–2579, 1963. DOI: 10.1021/ja00900a010. H. Meyer, K. Steiner. Über ein neues Kohlenoxyd C12O9. „Berichte der Deutschen Chemischen Gesellschaft”, s. 813–815, 1913. DOI: 10.1002/cber.191304601105. William S. Hummers, Richard E. Offeman. Preparation of Graphitic Oxide. „J. Am. Chem. Soc.”. 80 (6), s. 1339–1339, 1958. DOI: 10.1021/ja01539a017. Daniel R. Dreyer, Sungjin Park, Christopher W. Bielawski, Rodney S. Ruoff. The chemistry of graphene oxide. „Chemical Society Reviews”. 39 (1), s. 228–240, 2010. DOI: 10.1039/b917103g. W.B. DeMore, C.W. Jacobsen. Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide. „Journal of Physical Chemistry”. 9 (73), s. 2935–2938, 1969. DOI: 10.1021/j100843a026. Herman F. Cordes, Herbert P. Richter, Carl A. Heller. Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer). Chemiluminescent intermediate. „J. Am. Chem. Soc.”. 91 (25), s. 7209, 1969. DOI: 10.1021/ja01053a065. Corey S. Jamieson, Alexander M. Mebel, Ralf I. Kaiser. Novel detection of the C-2v isomer of carbon tetraoxide (CO4). „Chemical Physics Letters”. 1–3 (440), s. 105–109, 2007. DOI: 10.1016/j.cplett.2007.04.043. Errol Lewars. Polymers and oligomers of carbon dioxide: ab initio and semiempirical calculations. „Journal of Molecular Structure: THEOCHEM”. 363 (1), s. 1–15, 1996. DOI: 10.1016/0166-1280(95)04420-5. A.W. Snow, H. Haubenstock, N.-L. Yang. Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure. „Macromolecules”. 11 (1), s. 77–86, 1978. DOI: 10.1021/ma60061a015. Maier Günther, Hans Peter Reisenauer, Heinz Balli, Willy Brandt i inni. C4O2 (1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atoms. „Angewandte Chemie International Edition in English”. 29 (8), s. 905–908, 1990. DOI: 10.1002/anie.199009051. Maier Günther, Hans Peter Reisenauer, Ulrich Schäfer, Heinz Balli. C5O2 (1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon. „Angewandte Chemie International Edition in English”. 4 (27), 1988. DOI: 10.1002/anie.198805661. Frank W. Eastwood: Gas Phase Pyrolytic Methods for the Preparation of Carbon-Hydrogen and Carbon-Hydrogen-Oxygen Compounds. W: Yannick Vallée: Gas Phase Reactions in Organic Synthesis. CRC Press, 1997, s. 97. ISBN 978-90-5699-081-7. Günter Maier, Hans Peter Reisenauer: Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior. W: Advances in carbene chemistry. Udo H. Brinker (red.). Elsevier, 2001, s. 135. ISBN 978-0-444-50892-8. Teruhiko Ogata, Yoshio Tatamitani. The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions. „J. Phys. Chem. A”. 112 (43), s. 10713–10715, 2008. DOI: 10.1021/jp806725s. Einführung in die Theoretische Chemie. Wiley-VCH, 2002. ISBN 3-527-30609-9. Brak numerów stron w książce Detlef Schröder, Helmut Schwarz, Suresh Dua, Stephen J. Blanksby i inni. Mass spectrometric studies of the oxocarbons CnOn (n = 3–6). „International Journal of Mass Spectrometry”. 1–2 (188), s. 17–25, 1999. DOI: 10.1016/S1387-3806(98)14208-2. Werner Büchner, E. Weiss. Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK. „Helvetica Chimica Acta”. 46 (4), s. 1121–1127, 1963. DOI: 10.1002/hlca.19630460404. David Eggerding, Robert West. Synthesis of Dihydroxycyclopropenone (Deltic Acid). „J. American Chemical Society”. 97 (1), s. 207–208, 1975. DOI: 10.1021/ja00834a047. David Eggerding, Robert West. Synthesis and Properties of Deltic Acid (Dihydroxycyclopropenone) and the Deltate Ion. „J. American Chemical Society”. 98, s. 3641–3644, 1976. DOI: 10.1021/ja00428a043. Sidney Cohen, John R. Lacher, Joseph D. Park. Diketocyclobutanediol. „J. American Chemical Society”. 81, s. 3480, 1959. DOI: 10.1021/ja01522a083. Carl Löwig: Chemie der organischen Verbindungen''. Zürich: F. Schultess, 1839. Brak numerów stron w książce
R. West, J. Niu: Non-benzenoid aromatics. J. Snyder (red.). T. 1. New York: Academic Press, 1969. Brak numerów stron w książce
P.v.R. Schleyer, K. Najafian, B. Kiran, H. Jiao. Are Oxocarbon Dianions Aromatic?. „J. Org. Chem.”. 2 (65), s. 426–431, 2000. DOI: 10.1021/jo991267n. H.S. Verter, H. Porter, R. Dominic. A new carbon oxide: synthesis of tetrahydroxybenzoquinone bisoxalate. „Chemical Communications (London)”, s. 973b–974, 1968. DOI: 10.1039/C1968000973b. C. Nallaiah. Synthesis of tetrahydroxy-1,4-benzoquinone biscarbonate and hexahydroxybenzene triscarbonate – new organic carbon oxides. „Tetrahedron”. 40 (23), s. 4897–4900, 1984. DOI: 10.1016/S0040-4020(01)91324-9. Yves Rubin, Carolyn B. Knobler, Francois Diederich. Precursors to the cyclo[n]carbons: from 3,4-dialkynyl-3-cyclobutene-1,2-diones and 3,4-dialkynyl-3-cyclobutene-1,2-diols to cyclobutenodehydroannulenes and higher oxides of carbon. „J. Am. Chem. Soc.”. 4 (112), s. 1607–1617, 1990. DOI: 10.1021/ja00160a047. Paolo Strazzolini, Alberto Gambi, Angelo G. Giumanini, Hrvoj Vancik. The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger’s elusive ethanedioic (oxalic) acid anhydride. „J. Chem. Soc., Perkin Trans.”, s. 2553–2558, 1998. DOI: 10.1039/a803430c. Holger Butenschön. A new oxocarbon C12O6 via highly strained benzyne intermediates. „Angew Chem Int Ed Engl”, s. 4012–4014, 2007. DOI: 10.1002/anie.200700926. Diels, Otto, Wolf, Bertram. Ueber das Kohlensuboxyd. I. „Berichte der deutschen chemischen Gesellschaft”. 39 (1), s. 689–697, 1906. DOI: 10.1002/cber.190603901103. (niem.). B.D. Kybett, G.K. Johnson, C.K. Barker, J.L. Margrave. The Heats of Formation and Polymerization of Carbon Suboxide. „J. Phys. Chem.”. 69 (10), s. 3603–3606, 1965. DOI: 10.1021/j100894a060.











