Najlepsze pytania
Chronologia
Czat
Perspektywa
Bakteriorodopsyna
białko Z Wikipedii, wolnej encyklopedii
Remove ads
Bakteriorodopsyna – białko o masie 26 kDa występujące u halobakterii należących do domeny archeowców[1]. Zalicza się do białek określanych jako pompy protonowe, posiada zdolność przenoszenia protonów przez błonę komórkową pod wpływem światła[2]. Wytworzona różnica stężeń jonów wodorowych wykorzystywana jest następnie do syntezy ATP. Część naukowców proces syntezy ATP przy udziale bakteriorodopsyny traktuje jako rodzaj fotosyntezy[3]. Sztucznie wytworzone struktury zawierające błony z bakteriorodopsyną oraz syntazą ATP pochodzącą z mitochondriów posłużyły do doświadczalnego potwierdzenia chemiosmiotycznej teorii Mitchella[4]
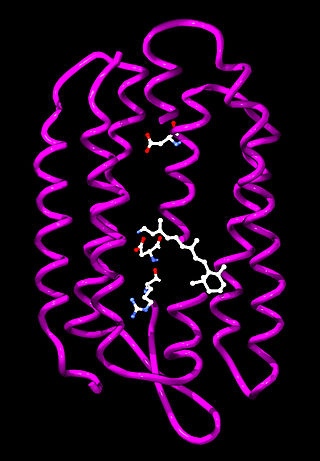


Bakteriorodopsyna jest integralnym białkiem błonowym zwykle tworzącym dwuwymiarowe plamy, określane jako „purpurowa błona”, których powierzchnia może obejmować do 50% powierzchni komórki archeowców. Powtarzające się elementy sześciokątnej siatki składają się z trzech identycznych łańcuchów białkowych, każdego obróconego o 120 stopni w stosunku do poprzedniego. Każdy łańcuch ma siedem transmembranowych alfa helis i zawiera jedną cząsteczkę retinalu[5].
Trzeciorzędowa struktura bakteriorodopsyny przypomina rodopsynę kręgowców, barwnik odpowiedzialny za reakcję na światło, obecny w siatkówce oka. Pomimo podobnej funkcji obu barwników, sekwencje aminokwasów łańcuchów białkowych znacznie się różnią. Zarówno rodopsyna, jak i bakteriorodopsyna należą do rodziny receptorów białkowych 7TM[6], jednak rodopsyna należy do receptorów sprzężonych z białkiem G, bakteriorodopsyna zaś nie. Struktura bakteriorodopsyny została poznana dzięki rentgenografii strukturalnej i opisana w po raz pierwszy w 1990 roku[7].
Bakteriorodopsyna ma barwię fioletową, a maksimum absorpcji przypada na długości fal odpowiadające barwie zielonej[8] (długość fali 500-650 nm, z maksimum absorpcji w 568 nm).
Pochłonięcie fotonu przez cząsteczkę retinalu prowadzi do zmian konformacyjnych części białkowej, których efektem jest przeniesienie protonu przez błonę komórkową. Grupa chromoforowa przyłączona jest kowalencyjnie do Lys216, tworząc zasadę Schiffa[9]. Po fotoizomeryzacji cząsteczki retinalu, proton przenoszony jest na Asp85. Miejsce przyłączenia protonu znajduje się po stronie zewnątrzkomórkowej. Retinal powraca do pierwotnej postaci w wyniku pobrania protonu z Asp96 znajdującej się po stronie wewnątrzkomórkowej. Proton z Asp85 uwalniany jest po stronie zewnątrzkomórkowej, a Asp96 pobiera proton z wnętrza komórki. W efekcie stężenie protonów wzrasta w przestrzeni zewnątrzkomórkowej i maleje wewnątrz komórki[10][11].
Znane są również inne białka o podobnych do bakteriorodopsyny właściwościach, przenosząca jony chlorkowe halorodopsyna oraz aktywowane przez światło kanały jonowe jak ChR1 i ChR2[12].
Aparat fotosyntetyczny niemal wszystkich organizmów fotosyntetyzujących oparty jest na chlorofilu lub bakteriochlorofilu. Pomimo zastosowania innego barwnika mechanizm przekształcania energii świetlnej na energię wiązań chemicznych na halobakterii jest podobny. W pierwszej fazie wytwarzany jest gradient protonowy, a w drugiej energia gradientu wykorzystywana jest przez syntezę ATP. W przypadku chlorofilu możliwe jest wykorzystanie jednocześnie wielu barwników absorbujących światło obecnych w antenach fotosyntetycznych, proces oparty na bakteriorodopsynie umożliwia wykorzystanie jedynie długości fal absorbowanych przez białko. Jest to jedyna forma fotosyntezy obecna u archeowców. Nie jest jednak połączona z asymilacją dwutlenku węgla[13].
Remove ads
Zobacz też
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
