Najlepsze pytania
Chronologia
Czat
Perspektywa
Energia jonizacji
Z Wikipedii, wolnej encyklopedii
Remove ads
Energia jonizacji, potencjał jonizacyjny atomu lub cząsteczki – minimalna energia, którą należy dostarczyć, aby oderwać elektron od atomu danego pierwiastka lub cząsteczki[1]. Przy jonizacji atomu znajdującego się w stanie podstawowym używa się określenia „pierwszy potencjał jonizacyjny”; przy odrywaniu kolejnych elektronów mówi się o drugim, trzecim, n-tym potencjale jonizacyjnym, określając w ten sposób energię potrzebną do oderwania n-tego elektronu po wcześniejszym oderwaniu n−1 elektronów.
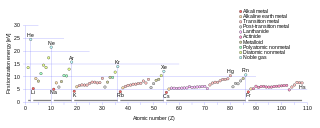
Kolejne potencjały jonizacyjne (szczególnie pierwszy) są wielkościami charakterystycznymi dla atomów i cząsteczek i decydują o ich własnościach fizycznych i chemicznych, dlatego podawane są w tabelach właściwości pierwiastków. Potencjał jonizacyjny podaje się w jednostkach energii na atom (elektronowolt na atom) lub na mol atomów (kilodżul/mol).
Remove ads
Związek z położeniem w układzie okresowym
Podsumowanie
Perspektywa
Energia jonizacji obojętnych atomów zależy od liczby atomowej i waha się w granicach od kilku do dwudziestu kilku eV. Jest ona równa energii wiązania najsłabiej związanego elektronu walencyjnego. Największą energię jonizacji mają atomy gazów szlachetnych, co jest związane z faktem, że pierwiastki te mają zapełnione powłoki walencyjne. Najmniejszą energię jonizacji mają pierwiastki z pierwszej grupy układu okresowego posiadające na powłoce walencyjnej jeden elektron.
Proces jonizacji opisuje równanie:
W miarę usuwania kolejnych elektronów atomu energia jonizacji powstałego kationu rośnie, przy czym największa energia jonizacji związana jest z oderwaniem elektronu z powłoki wewnętrznej. W układzie okresowym pierwiastków obserwuje się wzrost energii jonizacji w okresie z lewej na prawo i spadek w grupie z góry na dół.
Niektórzy naukowcy mówiąc o energii jonizacji odnoszą się do określonego stanu elektronowego (odpowiadającego wybiciu elektronu z określonego orbitalu atomowego) a czasem rozpatrują energię jonizacji cząsteczek (por. twierdzenie Koopmansa).
Energię jonizacji definiuje i wiąże z entalpią zależność:
gdzie:
- – temperatura,
- – energia jonizacji,
- – stała gazowa,
- – entalpia jonizacji.
Remove ads
Energie jonizacji atomów
Remove ads
Zobacz też
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads






